
| A£® | ĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Õż”¢Äę·“Ó¦ĖŁĀŹ¾łŌö“ó£¬ĒŅAµÄ×Ŗ»ÆĀŹŌö“ó | |
| B£® | T”ꏱ£¬ČōŌŚøĆČŻĘ÷ÖŠÓÉ0.4mol/LA”¢0.4mol/LBŗĶ0.2mol/LC·“Ó¦£¬“ļµ½Ę½ŗāŗó£¬CµÄÅضČČŌĪŖ0.4mol/L | |
| C£® | ŌŚ£Øt1+10£©minŹ±£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ | |
| D£® | £Øt1+10£©minŹ±£¬±£³ÖŃ¹Ēæ²»±ä£¬ĶØČėĻ”ÓŠĘųĢå£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
·ÖĪö øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬AÅØ¶ČµÄ±ä»ÆĮæ=£Ø0.5-0.3£©mol/L=0.2mol/L£¬BÅØ¶ČµÄ±ä»ÆĮæ=£Ø0.7-0.1£©mol/L=0.6mol/L£¬CÅØ¶ČµÄ±ä»ÆĮæ=£Ø0.4-0£©mol/L=0.4mol/L£¬Ķ¬Ņ»»Æѧ·“Ó¦Ķ¬Ņ»Ź±¼ä¶ĪÄŚ£¬ø÷ĪļÖŹÅØ¶ČµÄ±ä»ÆĮæÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£¬ĖłŅŌøĆ·“Ó¦·½³ĢŹ½ĪŖ£ŗA£Øg£©+3B£Øg£©?2C£Øg£©£¬
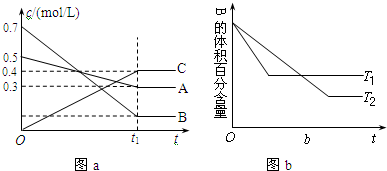
øł¾Ż”°ĻČ¹ÕĻČĘ½ŹżÖµ“ó”±½įŗĻĶ¼IIÖŖ£¬T1£¾T2£¬ÉżøßĪĀ¶Č£¬BµÄĢå»ż·¢ÉśŌö“ó£¬ŌņøĆ·“Ó¦µÄÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦£»
A£®øł¾Ż”°ĻČ¹ÕĻČĘ½ŹżÖµ“ó”±½įŗĻĶ¼¢ņÖŖ£¬T1£¾T2£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£»
B£®ĻČøł¾ŻĶ¼¢ń¼ĘĖćĘ½ŗā³£Źż£¬ŌŁøł¾ŻĘ½ŗā³£Źż¼ĘĖćøıäČżÖÖĪļÖŹµÄÅØ¶Č“ļµ½Ę½ŗāדĢ¬Ź±CµÄÅØ¶Č£»
C£®Ōö“óŃ¹Ēæ£¬Ę½ŗāĻņĘųĢåĢå»ż¼õŠ”µÄ·½ĻņŅĘ¶Æ£»
D£®ĘäĖüĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬ÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“ó£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£®
½ā“š ½ā£ŗ·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬AÅØ¶ČµÄ±ä»ÆĮæ=£Ø0.5-0.3£©mol/L=0.2mol/L£¬BÅØ¶ČµÄ±ä»ÆĮæ=£Ø0.7-0.1£©mol/L=0.6mol/L£¬CÅØ¶ČµÄ±ä»ÆĮæ=£Ø0.4-0£©mol/L=0.4mol/L£¬Ķ¬Ņ»»Æѧ·“Ó¦Ķ¬Ņ»Ź±¼ä¶ĪÄŚ£¬ø÷ĪļÖŹÅØ¶ČµÄ±ä»ÆĮæÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£¬ĖłŅŌøĆ·“Ó¦·½³ĢŹ½ĪŖ£ŗA£Øg£©+3B£Øg£©?2C£Øg£©£¬
øł¾Ż”°ĻČ¹ÕĻČĘ½ŹżÖµ“ó”±½įŗĻĶ¼¢ņÖŖ£¬T1£¾T2£¬ÉżøßĪĀ¶Č£¬BµÄĢå»ż·¢ÉśŌö“ó£¬ŌņøĆ·“Ó¦µÄÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦£»
A£®ĘäĖüĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬ÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“ó£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£¬øł¾ŻĶ¼¢ņÖŖ£¬Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ĖłŅŌĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬AµÄ×Ŗ»ÆĀŹ½µµĶ£¬¹ŹA“ķĪó£»
B£®øł¾ŻĶ¼¢ńÖŖ£¬»ÆŃ§Ę½ŗā³£ŹżK=$\frac{£Ø0.4£©{\;}^{2}}{0.3”Į£Ø0.1£©{\;}^{3}}$=$\frac{1600}{3}$£¬
¼ŁÉčCµÄĘ½ŗāÅØ¶ČŹĒ0.4mol/L£¬
A£Øg£©+3B£Øg£©?2C£Øg£©
æŖŹ¼£Ømol/L£©0.4 0.4 0.2
·“Ó¦£Ømol/L£©0.1 0.3 0.2
Ę½ŗā£Ømol/L£© 0.3 0.1 0.4
»ÆŃ§Ę½ŗā³£ŹżK”ä=$\frac{£Ø0.4£©{\;}^{2}}{0.3”Į£Ø0.1£©{\;}^{3}}$=$\frac{1600}{3}$£¬ĖłŅŌ·ūŗĻĘ½ŗā³£ŹżK£¬¹ŹBÕżČ·£»
C£®øĆ·“Ó¦µÄÕż·“Ó¦ŹĒĘųĢåĢå»ż¼õŠ”µÄ·“Ó¦£¬£Øt1+10£©minŹ±£¬±£³ÖĘäĖüĢõ¼žŗĶĪļ֏דĢ¬²»±ä£¬Ōö¼ÓŃ¹Ē棬»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬¹ŹC“ķĪó£»
D£®£Øt1+10£©minŹ±£¬±£³ÖŃ¹Ēæ²»±ä£¬ĶØČėĻ”ÓŠĘųĢå£¬ČŻĘ÷Ģå»ż±ä“󣬷“Ó¦ĪļĖłÕ¼·ÖŃ¹¼õŠ”£¬Ę½ŗāĻņĢå»żŌö“óµÄ·½ĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬¹ŹD“ķĪó£»
¹ŹŃ”£ŗB£®
µćĘĄ ±¾Ģāæ¼²éĶā½ēĢõ¼ž¶Ō»ÆŃ§Ę½ŗāŅĘ¶ÆµÄÓ°Ļģ£¬ÕżČ·Č·¶Ø·“Ó¦·½³ĢŹ½ŹĒ½ā±¾Ģā¹Ų¼ü£¬»įøł¾Ż”°ĻČ¹ÕĻČĘ½ŹżÖµ“ó”±Č·¶ØøĆ·“Ó¦ŹĒĪüČČ·“Ó¦»¹ŹĒ·ÅČČ·“Ó¦£¬ÄѶČÖŠµČ£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| A | B | |
| C | D |

| »Æѧ¼ü | H-H | Br-Br | H-Br |
| ¼üÄÜ£ØkJ/mol£© | 436 | 194 | 362 |
| »ÆѧŹ½ | Ag2SO4 | AgBr |
| Čܽā¶Č£Øg£© | 0.796 | 8.4”Į10-6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĮņŹĒŅ»ÖÖŅ×ČÜÓŚĖ®µÄ»ĘÉ«¾§Ģå | |
| B£® | SO2ČÜÓŚĖ®Éś³ÉH2SO4 | |
| C£® | ÓĆĒāŃõ»ÆÄĘČÜŅŗ“¦Ąķŗ¬ÓŠSO2µÄĪ²Ęų | |
| D£® | ÅØH2SO4²»ĪČ¶Ø£¬¹āÕÕŅ×·Ö½ā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀĮĶ¶ČėŃĪĖįÖŠ | B£® | ŅŗĢ¬Ė®±ä³ÉĖ®ÕōĘų | ||
| C£® | ģŃÉÕŹÆ»ŅŹÆÉś³ÉÉśŹÆ»ŅŗĶ¶žŃõ»ÆĢ¼ | D£® | Ńõ·Ö×Ó±ä³ÉŃõŌ×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¾Ū±ūĻ©µÄ½į¹¹¼ņŹ½£ŗ | B£® | ±ūĶé·Ö×ӵıȥżÄ£ŠĶ£ŗ | ||
| C£® | Č©»łµÄµē×ÓŹ½£ŗ | D£® | ČżĻõ»ł¼×±½µÄ½į¹¹£ŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C60 | B£® | CaCl2 | C£® | KF | D£® | C4H10 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ +O2$”ś_{”÷}^{Cu}$
+O2$”ś_{”÷}^{Cu}$ +2H2O£®
+2H2O£® 1molNaOHČÜŅŗ·“Ó¦×ī¶ąĻūŗÄ4molNaOH£¬1moløĆĪļÖŹŅņ·¢Éś¼Ó³É·“Ó¦æÉĻūŗÄ1molBr2£®
1molNaOHČÜŅŗ·“Ó¦×ī¶ąĻūŗÄ4molNaOH£¬1moløĆĪļÖŹŅņ·¢Éś¼Ó³É·“Ó¦æÉĻūŗÄ1molBr2£® øĆ·Ö×ÓÖŠŅ»¶ØÓė±½»·“¦ÓŚĶ¬Ņ»Ę½ĆęµÄĢ¼Ō×ÓÓŠ4øö£Ø²»°üĄØ±½»·ÉĻµÄĢ¼Ō×Ó£©£¬·Ö×ÓÖŠŗ¬ÓŠ2ÖÖĖ«¼ü£®
øĆ·Ö×ÓÖŠŅ»¶ØÓė±½»·“¦ÓŚĶ¬Ņ»Ę½ĆęµÄĢ¼Ō×ÓÓŠ4øö£Ø²»°üĄØ±½»·ÉĻµÄĢ¼Ō×Ó£©£¬·Ö×ÓÖŠŗ¬ÓŠ2ÖÖĖ«¼ü£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{m}{16}$ | B£® | 16m | C£® | $\frac{m}{32}$ | D£® | 32m |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Zn£Øs£©+CuSO4£Øaq£©ØTZnSO4£Øaq£©+Cu£Øs£©”÷H=-216kJ•mol-1£¬Ōņ·“Ó¦Īļ×ÜÄÜĮæ£¾Éś³ÉĪļ×ÜÄÜĮæ | |
| B£® | ĻąĶ¬Ģõ¼žĻĀ£¬Čē¹ū1molĒāŌ×ÓĖł¾ßÓŠµÄÄÜĮæĪŖE1£¬1mol Ēā·Ö×ÓĖł¾ßÓŠµÄÄÜĮæĪŖE2£¬Ōņ2E1=E2 | |
| C£® | 101 kPaŹ±£¬2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-571.6 kJ•mol-1£¬ŌņH2µÄČ¼ÉÕČČĪŖ”÷H=-571.6 kJ•mol-1 | |
| D£® | H+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3 kJ•mol-1£¬Ōņ1molNaOHµÄĒāŃõ»ÆÄĘ¹ĢĢåÓėŗ¬0.5molH2SO4µÄĻ”ĮņĖį»ģŗĻŗó·Å³ö57.3kJµÄČČĮæ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com