
分析 (1)H2O2仅体现氧化性,则O元素的化合价降低;双氧水仅体现还原性,说明双氧水在反应中仅被氧化,化合价只升高;H2O2既体现氧化性又体现还原性,则O元素的化合价既升高又降低;H2O2既不做氧化剂又不做还原剂,说明在反应中双氧水的化合价不发生变化;
(2)过氧化氢为常见的强氧化剂;
(3)KCN+H2O2+H2O═A+NH3↑中遵循元素、原子守恒,以此推断A的分子式.
解答 解:(1)A.Na2O2+2HCl=2NaCl+H2O2,是一个非氧化还原反应,双氧水既不是氧化剂,也不是还原剂,故A不选;
B.Ag2O+H2O2=2Ag+O2↑+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中氧元素转化为O2,故B不选;
C.2H2O2=2H2O+O2↑,过氧化氢的分解反应,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性,故C不选;
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,双氧水在反应中化合价由-1变成-2,化合价降低被还原,双氧水仅做氧化剂,故D选;
故答案为:D;
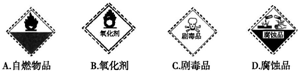
(2)过氧化氢为常见的强氧化剂,无毒、不具有腐蚀性,也不自燃,则只有B中标签符合,故答案为:B;
(3)KCN+H2O2+H2O═A+NH3↑中遵循元素、原子守恒,可知生成物A应该是KHCO3,故答案为:KHCO3.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、质量守恒定律为解答的关键,侧重分析与应用能力的考查,注意物质性质及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
| 熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
| A. | SiCl4是分子晶体 | |
| B. | MgCl2中键的强度比NaCl中键的强度小 | |
| C. | 单质R可能是原子晶体 | |
| D. | AlCl3为离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 丙烯分子存在非极性键 | |
| C. | 丙烯分子有6个σ键,1个π键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X位于元素周期表中第2周期ⅤA族 | |
| B. | X元素有-3、+5两种化合价 | |
| C. | X元素在元素周期表中的族序数肯定为奇数 | |
| D. | X元素最高价氧化物对应的水化物可以表示为H3XO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com