
下图(I)是实验室制取气体的一种发生装置。
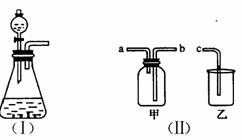
(1)若用上述装置制取O2,可选择二氧化锰和 反应,写出此反应的化学方程式 。
(2)选择图(II)中的甲装置,若用排空气法收集CO2,收集时气体应从 口进气;若用排水法收集O2,收集时气体应从 口进气。(填“a”或“b”)
(3)实验室以KMnO4和浓盐酸为反应物,利用(I)、(II)装置组合制取氯气,反应方程式如下:
□KMnO4+□HCl=□KCl+□MnCl2+□Cl2↑+□H2O
①配平上述反应方程式(在空格里填上适合的计量系数);
盐酸在此反应中体现的性质为
②组合装置乙中盛放氢氧化钠溶液,发生反应的离子方程式为 。
(4)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种用途的装置。如充当集气瓶,还可作 (填写一种即可)
科目:高中化学 来源: 题型:





| 催化剂 |
| △ |
| 催化剂 |
| △ |


| 甲烷菌 |
 +14CD2T2,在同样条件下,完成下列反应:2CH3CH2OD+C18O2
+14CD2T2,在同样条件下,完成下列反应:2CH3CH2OD+C18O2| 甲烷菌 |


查看答案和解析>>
科目:高中化学 来源: 题型:
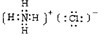
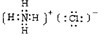
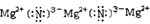
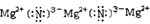
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

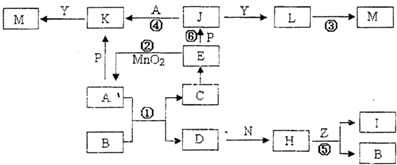
(1)写出下列物质的结构简式:高分子化合物F________;六元环状化合物I________。
(2)C→D的反应类型为________。D→E的反应类型为________。
(3)写出下列反应的化学方程式:A→B ________________________ ;
C→可降解塑料 ________________________________ 。
(4)H分子所含官能团的名称是____________,实验室中常用于检验该官能团的试剂的名称是________ (只写一种)。
(5)G转变成CH4的反应曾做过如下的同位素示踪实验(D、T为H的同位素):
![]()
在同样条件下,完成下列反应:2CH3CH2OD+C18O2![]() ___________+___________。
___________+___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下:
请回答:
(1)步骤I、III中需用到氨气,下列装置可用于实验室制氨气的是_________。(填序号)
(2)写出步骤I中发生的化学反应方程式
_______________________________________________________。
若用右图装置进行该沉淀反应。实验时,须先从_____(填“a”、“b”或“c”)管通入_____气体。
(3)步骤III向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①此处通入氨气的作用是_________。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
②已知四种相关物质不同温度下的溶解度曲线如图所示。结晶时宜采用___________(填“蒸发结晶”或“降温结晶”)。
③有人设计了如下图所示的装置来验证所得的晶体中含有NH4+。
具体操作:取少量晶体于硬质试管,对晶体部位加热。并在_____
(填“A”或“B”)处放置______________试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;
仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等
① _________________溶于水,加入__________________________。
②过滤、洗涤、烘干,冷却、称量,并进行_____________操作(写操作名称)。
③计算。若数据处理时将所得固体质量1.977 g错看为1.971 g,由此产生的相对误差为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com