
【题目】用20mL 18.4molL﹣1 浓H2SO4与金属铜共热一段时间后,冷却,过滤,除去多余的铜,将滤液加水稀释到100mL,所得溶液中SO42﹣的物质的量浓度为3.18molL﹣1 , 则此时溶液中CuSO4的物质的量浓度为( )
A.0.50 molL﹣1
B.0.75 molL﹣1
C.1.00 molL﹣1
D.3.18 molL﹣1
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】碳、氮、氧是同周期相邻的三种元素,碳、氮、氧及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
(1)碳、氮、氧的第一电离能由大到小顺序为
(2)H2O的中心原子杂化轨道空间构型为 , 固态H2O的晶体类型为 ,
(3)比较键角的大小:H2OCH4(填“>”“<”或“=”),原因为
(4)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 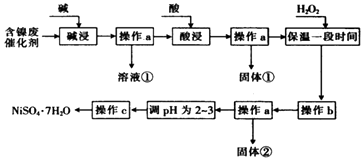
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题 I.某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验:
①取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4 , 振荡后静置,观察到下层液体呈紫红色;
②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色.
(1)写出实验②中发生氧化还原反应的离子方程式: .
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是 .
A.Br2>I2
B.Fe3+>Br2
C.Br2>Fe3+
D.I﹣>Br﹣
(3)II.被誉为“江南小三峡”的南京胭脂河是明代初年开凿的一条人工运河.因其“石有胭脂色”而得名.胭脂河沿岸的那些红色石块的成分是什么?某研究性学习小组取一小块这种红色石块A,粉碎后对其成分进行实验探究,实验记录如图所示. 
请你根据使用推断:
A中含有的酸根离子(填离子符号).B中肯定含有的溶质是(写化学式).
写出实验中有关反应的化学方程式:
②
⑤ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
A.26g
B.36g
C.104g
D.37.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列反应对应的曲线错误的是( ) 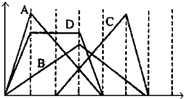
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H﹣1O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5 OH﹣═FeO ![]() +4H2O
+4H2O
C.放电时正极附近溶液的碱性增强
D.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月的eLife上发表了浙江医科大学第二医院和浙江大学肿瘤研究所的晁明和胡汛等人的一篇论文.媒体以“用十几块钱的小苏打饿死了癌细胞”为题予以报道,报道曲解了小苏打的作用,但小苏打在他们治疗癌症的方法中确实功不可没.
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品.
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体.继续向C中通入两种气体,直到不再有固体产生.
第三步:分离C中所得的混合物,得到NaHCO3固体.
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出.
(1)如图所示装置的连接顺序是:a接;接;b接(填接口编号). 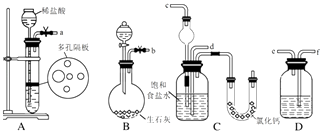
(2)A中常选用的固体反应物为;D中应选用的液体为 .
(3)第二步中让装置先发生反应.
(4)C中用球形干燥管而不用直导管,其作用是;装有无水CaCl2的U形管的作用是 .
(5)第三步分离出NaHCO3固体的操作是 .
(6)第四步中所加固体粉末化学式为 . 所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1.简要写出操作和现象 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在自然界中都以典型的盐类存在,包括氟、氯、溴、碘和砹五种元素,位于元素周期表的第ⅦA族,其中氯、溴和碘主要来自海水.卤素元素在生产实际中承担着重要角色.请回答下列问题:
(1)将经过验纯的氢气点燃,伸入盛有氯气的集气瓶中,在集气瓶口可观察到的现象是
(2)欲检验Na2CO3、Na2SO4、NaCl的混合溶液中的Cl﹣ , 正确的操作方法是
(3)海水晒盐所获取的粗盐,经过提纯、精制之后,其水溶液进行电解,可以得到重要的化工原料.请写出该电解反应的离子方程式 . 海带中提取碘时,将海带烘干、灼烧目的是 .
(4)将0.01molCl2通入含0.03molNaBr和0.03molKI的混合液中,发生反应的离子方程式为 再将所得溶液分为两等份,其中一份蒸干、灼烧,最后得到的固体的成分一定有KCl,还有;另一份再加入少量CCl4 , 振荡,则CCl4层的颜色是 , 分离CCl4层和水层的操作名称是 , 需要使用的玻璃仪器除烧杯外,还有 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com