
| A. | 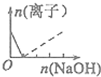 | B. | 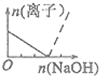 | C. | 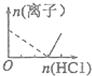 | D. | 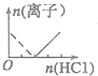 |
分析 A、B.根据图象知,实线发生的反应为Al3++3OH-═Al(OH)3↓,虚线发生的反应为 Al(OH)3+OH-═AlO2-+2H2O,根据原子守恒知,铝离子的最大值等于偏铝酸根离子的最大值,根据两个方程式和氢氧化钠的量判断;
C、D.根据图象知,虚线发生的反应为AlO2-+H++H2O═Al(OH)3 ↓,实线发生的反应为Al(OH)3+3H+═Al3++3H2O,根据方程式知,第一个方程式知盐酸的物质的量是第二个方程式的3倍,即拐点左右两边横坐标的比值为3:1.
解答 解:A.实线发生的反应为Al3++3OH-═Al(OH)3↓,虚线发生的反应为 Al(OH)3+OH-═AlO2-+2H2O,根据原子守恒知,铝离子的最大值等于偏铝酸根离子的最大值,且第一个方程式中需要的氢氧化钠是第二个方程式的3倍,所以其纵坐标为0时,曲线拐点左右两边的氢氧化钠的物质的量之比为3:1,故A错误;
B.根据A的分析知,B正确;
C.向偏铝酸盐溶液中滴加盐酸先发生AlO2-+H++H2O═Al(OH)3 ↓,当沉淀最大时,继续滴加盐酸,发生反应Al(OH)3+3H+═Al3++3H2O,根据原子守恒知,偏铝酸根离子和铝离子的物质的量的最大值相等,根据方程式知,第一个方程式知盐酸的物质的量是第二个方程式的3倍,即拐点左右两边横坐标的比值为1:3,故C错误;
D.根据C的分析知,故D错误;
故选B.
点评 本题考查了铝盐和氢氧化钠溶液及偏铝酸盐和盐酸的混合,明确铝盐中滴加氢氧化钠过程发生的化学反应及偏铝酸盐中滴加盐酸过程发生的反应即可解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业中,三氧化硫在吸收塔内被水吸收制成浓硫酸 | |
| B. | 炼铁工业中,用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁 | |
| C. | 合成氨工业中,用铁触媒作催化剂,可提高单位时间氨的产量 | |
| D. | 氯碱工业中,电解槽的阴极区产生NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
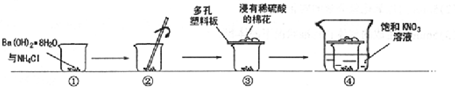
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量变化如图所示的反应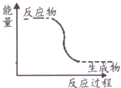 | |
| B. | 中和反应 | |
| C. | 化学键断裂吸收的热量比化学键生成放出的热量少的反应 | |
| D. | Ba(OH)2•8H2O晶体和NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | B. | 氧化性:Na+>K+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 酸性:HF>HCl>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 百炼成钢 | B. | 饮鸩止渴 | C. | 铁杵磨针 | D. | 火上浇油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
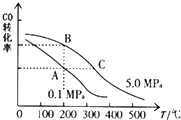 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com