
【题目】下列各组微粒在水溶液中大量共存的是
A. Na+、I-、K+、Br2 B. Mg2+、Cu2+、SO42-、NO3-
C. Fe2+、Cl2、K+、SO42- D. ClO-、Cl-、CO2、Na+
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A 可能是下列物质中的( )

①金属钠 ②硫单质 ③NH3 ④Na2C03 ⑤AlCl3溶液 ⑥单质铁
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用右图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。

已知:3I2+6OH-= IO3-+5I-+3H2O
回答下列问题:
(1)左侧为电源__________极。(填“正”或“负”)
(2)请用方程式及必要的文字解释左侧溶液变蓝色的原因?___________________。
(3)写出右侧发生的有关电极反应的反应式:_____________________。
(4)电解反应结束时,左侧溶液中还_________I-。(填“有”或“没有”)
(5)写出电解槽内发生反应的总化学方程式:_____________________。
(6)如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应_________。(填“变”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知在碱性溶液中可发生如下反应:2R(OH)3+3C1O-+4OH- =2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( )
A. +2 B. +4 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关过滤和蒸发的操作中,正确的是( )
A.过滤时,漏斗的下端管口紧靠烧杯内壁
B.为了加快过滤速度,可用玻璃棒搅动过滤器中的液体
C.当蒸发皿中的固体完全蒸干后,再停止加热
D.实验完毕后,用手直接取走蒸发皿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
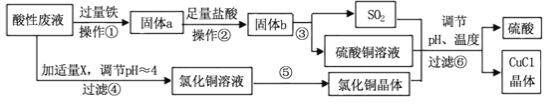
请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式: 。
(2)步骤②的操作名称是: 。
(3)步骤④中所加物质X为: 。
(4)步骤⑤的操作是: 。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。
(6)在CuCl的生成过程中,可以循环利用的物质是 ,理论上 (填“是”或“不”)需要补充(不考虑调节等消耗);理由是 。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。电解CuCl2溶液,阴极上发生的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO41000mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.老师要求把①②两种硫酸全部用完,不足的部分由③来补充.请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L(保留1位小数).
(2)配制该硫酸溶液应选用容量瓶的规格为 mL.
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,沿玻璃棒倒入上述混合液中.并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm 处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(4)定容时俯视刻度线,会使所配溶液浓度 (填“偏大”、“偏小”或“无影响”).
(5)进行操作C前还需注意 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常用离子检验方法有沉淀法:反应中有沉淀产生或溶解;气体法:反应中有气体产生;显色法:反应中有颜色变化.下列离子检验方法不可能涉及沉淀法的是( )
A.NH4+
B.Ca2+
C.I﹣
D.SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl26H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl26H2O的一种新工艺流程如图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3
开始沉淀 2.3 7.5 7.6 3.4
完全沉淀 4.1 9.7 9.2 5.2
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为_________(写一点).
(2)加入碳酸钠调节pH至a,a的范围是 _________;再用试剂X将滤液的pH调节至2﹣3,则所用的试剂X为 _________.
(3)操作Ⅰ包含3个基本实验操作,它们是 _________、 _________和过滤.
(4)制得的CoCl26H2O需减压烘干的原因是 _________.
(5)为测定产品中CoCl26H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl26H2O的质量分数大于100%,其原因可能是 _________.
(6)在实验室中,为了从上述产品中获得纯净的CoCl26H2O,常将制得的产品溶解于乙醚中,然后 _________、 _________(填实验操作)获得纯净的CoCl26H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com