
| A、在硫酸铝溶液中滴加过量氨水 |
| B、在氯化镁溶液中滴加过量的烧碱溶液 |
| C、在偏铝酸钠溶液中通入过量CO2 |
| D、在氯化钙溶液中通入过量的二氧化碳 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
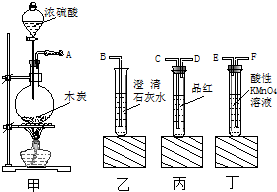 为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置[已知:酸性H2SO3>H2CO3,Ca(HSO3)2溶于水]:
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置[已知:酸性H2SO3>H2CO3,Ca(HSO3)2溶于水]:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 银氨溶液 | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
| (NH4)2S |
| ① |
| 过滤、洗涤 |
| ② |
| 烘干 |
| ③ |
| 铁粉还原 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
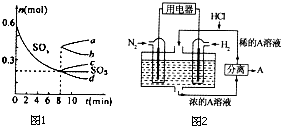 运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,NA个SO3分子所占的体积约为22.4 L |
| B、5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C、铁粉与一定量的浓硫酸反应,若产生11.2 L SO2和1 g H2,铁粉失去的电子数为2NA |
| D、50 mL 12 mol?L-1 浓盐酸与足量二氧化锰反应,转移电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com