
����Ŀ��X��T��Y��ZΪ1��36��Ԫ�أ���ԭ������������������Ԫ�ص����ʻ�ṹ��Ϣ������������Ϣ�ش��������⣮
Ԫ�� | T | X | Y | Z |
���ʽṹ��Ϣ | ԭ�Ӻ���s������������p���������������ں�������Ԫ�أ����䵥���dz�������ȼ�� | ����Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷԣ������µ��������ȶ�������ԭ�ӽϻ��� | ��3����Ԫ�صļ������а뾶��С | ��4����Ԫ�أ�M���Ӳ�Ϊȫ����״̬�������ֻ��һ�����ӵ�ԭ�� |
��1��д��Ԫ��T�����ӽṹʾ��ͼ��д��Ԫ��X����̬�⻯��ĵ���ʽ��X�γɵĵ��ʷ��ӣ������Ҽ������м���д��ZԪ��ԭ�ӵ���Χ�����Ų�ʽ��Ԫ��Y��ԭ�Ӻ��������״��ͬ�ĵ����ƣ�
��2��Y����������������Һ��Ӧ�����ӷ���ʽ�� ��
��3��Ԫ��T���Ԫ����ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ�������������ĸ����
a�������·�������ɫ��T���ʵ���ɫ��
b��������T���⻯����ҷ�Ӧ������T�ĵ���
c������T�γɵĻ�������TԪ�س�����̬
d���Ƚ���Ԫ�صĵ�������������ʱ�õ��ӵ���Ŀ��
���𰸡�
��1�� ��
��![]() ��1��2��3d104s1��2
��1��2��3d104s1��2
��2��2Al+2OH��+2H2O=2AlO2��+3H2��
��3��F��bc
���������⣺��1��Ԫ��T������ΪO2�� �� O2�����ӽṹʾ��ͼΪ  ��Ԫ��X����̬�⻯��ΪNH3 �� ����ʽΪ
��Ԫ��X����̬�⻯��ΪNH3 �� ����ʽΪ ![]() ��N2�����д���N��N������1���Ҽ���2���м���ZΪCu����Χ�����Ų�ʽΪ3d104s1 �� YΪAl��������s��p�ܼ�������2�ֲ�ͬ��״�ĵ����ƣ����Դ��ǣ�
��N2�����д���N��N������1���Ҽ���2���м���ZΪCu����Χ�����Ų�ʽΪ3d104s1 �� YΪAl��������s��p�ܼ�������2�ֲ�ͬ��״�ĵ����ƣ����Դ��ǣ�  ��
�� ![]() ��1��2��3d104s1��2����2��Z����ΪAl��Y����������ˮ����ΪNaOH�����߷�Ӧ����ƫ����������������Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2����
��1��2��3d104s1��2����2��Z����ΪAl��Y����������ˮ����ΪNaOH�����߷�Ӧ����ƫ����������������Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2����
���Դ��ǣ�2Al+2OH��+2H2O=2AlO2��+3H2������3��Ԫ�������Ԫ����ȣ��ǽ����Խ�ǿ����FԪ�أ�
a��������ɫ�����������ʣ����ܱȽ�Ԫ�طǽ�����ǿ������a����
b��������T���⻯����ҷ�Ӧ������T�ĵ��ʣ�˵�����������Ը�ǿ������˵����Ԫ�طǽ�����ǿ����b��ȷ��
c������T�γɵĻ�������TԪ�س�����̬��˵��FԪ�ضԼ��ϵ���������ǿ�����Ԫ�طǽ����Ը�ǿ����c��ȷ��
d���ǽ�����ǿ�����õ������׳̶��йأ����õ�����Ŀ�����أ���d����
���Դ��ǣ�F��bc��


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���ֶ�����Ԫ�أ�ԭ�Ӱ뾶�Ĵ�С��ϵΪ��r(y)>r(x)>r(z)��ԭ������֮��Ϊ16��X��Y��Z����Ԫ�صij����������ʵ������¿ɷ�����ͼ��ʾ�仯������B��C��Ϊ10���ӷ��ӡ�����˵������ȷ����

A. XԪ��λ����A
B. A�����ܽ���B��
C. B�ķе����C�ķе�
D. A��C�����ܷ���������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ��������ص㣬��NaK�Ͻ�ΪҺ�壬��Na��K�ĵ��ʾ�Ϊ���塣�ݴˣ����Ʋ⣺������������̼���������У��۵���͵���(����)
A.����
B.����
C.̼
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������ؾ����������ṹ�����������Ļ��ϼ۲���Ϊ0�ۣ�����Ϊ��2�ۣ�����ͼ��ʾΪ�������ؾ����һ��������������˵����ȷ���ǣ� �� 
A.�������صĻ�ѧʽΪKO2 �� ÿ����������4��K+��4��O2��
B.������ÿ��K+��Χ��8��O2�� �� ÿ��O2����Χ��8��K+
C.��������ÿ��K+���������K+��8��
D.��������ÿ��K+���������K+��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25 mL�ļ�ʽ�ζ�����ʢ����Һ��Һ��ǡ����20 mL�̶ȴ����ֽ��ζ�������Һȫ���ų���������Ͳ�ڣ�������Һ�����Ϊ(����)
A.5 mL
B.20 mL
C.����5 mL
D.��5 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ��(�г�װ����)��ȡ���ռ�����������İ�������̽�����������ʡ�
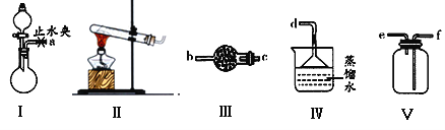
��1��ʵ������NH4Cl��Ca(OH)2��ȡ������д����Ӧ�Ļ�ѧ����ʽ��_______________��Ӧѡ�õķ���װ����_____���ܷ�������林����Ȼ��___(��ܡ����ܡ�)��
��2��������װ��I��ȡ����������ʵ��Ҫ��
���������ӵ�˳������ĸ��ű�ʾ����
a��_____�� �� �� �� ��
��װ��IӦѡ�õ��Լ�ΪŨ��ˮ_______ �� ______(����ţ���
A.���Ȼ��� B.Ũ���� C.����� D.��ʯ��
��Ϊ�˵õ�����İ�����ʵ���Ҳ������ڸ���NH3���Լ���_________��
A.Ũ���� B.��ʯ�� C.NaOH����
��3���ռ�һƿ����������ͼ����װ�ý���ʵ�顣�ȴ������٣�Bƿ�в�����ɫ������__________���ѧʽ�����ȶ��ر������٣��ٴ������ڣ�Bƿ�е�������__________________________________��
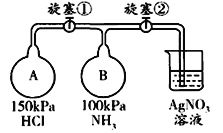
��4��������ͨ��ʢ������ͭ��ĩ�IJ������У������к�ɫ���嵥�ʺ���ɫ���嵥�����ɣ�֤����������________�ԣ���Ӧ�Ļ�ѧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�������������Ƿ��ѱ���������ѡ�Լ�(����������)����ȷ����(����)
A.�Ȼ�������Һ(���軯����Һ)
B.�⻯����Һ(������Һ)
C.��ȩ(��ɫʯ����Һ)
D.����������Һ(�Ȼ�����Һ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NH3����ԭNxOy�������������������Ⱦ����֪����ӦI��4NH3��g��+6NO��g��5N2��g��+6H2O��l����H1
��ӦII��2NO��g��+O2��g��2NO2��g����H2 ����|��H1|=2|��H2|��
��ӦIII��4NH3��g��+6NO2��g��5N2��g��+3O2��g��+6H2O��l����H3
��ӦI�ͷ�ӦII�ڲ�ͬ�¶�ʱ��ƽ�ⳣ�������С��ϵ���±�
�¶�/K | ��ӦI | ��ӦII | ��֪�� |
298 | K1 | K2 | |
398 | K1�� | K2�� |
��1���ƲⷴӦIII����Ӧ������ȡ����ȡ���
��2����ͬ�����£���ӦI��2L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ�������Ӧ����N2������ʱ��仯��ͼ1��ʾ���ټ���0��4������A���������£���Ӧ����v��NO��= ��
������˵����ȷ���� ��
A���÷�Ӧ�Ļ�ܴ�С˳���ǣ�Ea��A����Ea��B����Ea��C��
B������ѹǿ��ʹ��Ӧ���ʼӿ죬����Ϊ�����˻���Ӱٷ���
C����λʱ����H��O����N��H�����ѵ���Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��
D�����ں��ݾ��ȵ��ܱ������з�����Ӧ����Kֵ����ʱ��˵����Ӧ�Ѿ��ﵽƽ��
��3��һ�������£���ӦII�ﵽƽ��ʱ��ϵ��n��NO����n��O2����n��NO2��=2��1��2����������������ʱ���ٳ���NO2���壬����NO2������������գ�NO2���ı仯���������������С�����䡱�����º�ѹ�������գ�NO2�������º����������գ�NO2�� ��
��4��һ���¶��£���ӦIII���ݻ��ɱ���ܱ������дﵽƽ�⣬��ʱ�ݻ�Ϊ3L��c��N2���뷴Ӧʱ��t�仯����X��ͼ2��ʾ������t1ʱ�̸ı�һ������������X��Ϊ����Y������Z���ٱ�Ϊ����Y�ı�������� �� ��Ϊ����Z�ı�������� �� 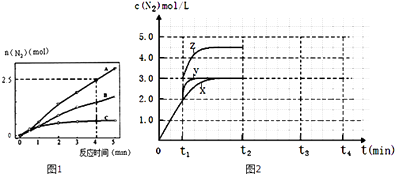
����t2�����¶ȣ�t3�ﵽƽ�⣬������ͼ�л�������X��t2��t4�� c��N2���ı仯���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ԫ�����ڱ���ǰ36��Ԫ�أ����ǵĺ˵�����������ڶ�����Ԫ��Aԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������2������3���ܼ���Bԭ�ӵ������p����ĵ���Ϊ������ṹ��C�ǵؿ��к�������Ԫ�أ�D�ǵ�������Ԫ�أ���ԭ�Ӻ�����������������ԭ����ͬ�����������Ӿ���������ش��������⣺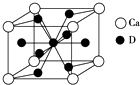
��1��A��B��C�ĵ�һ��������С�����˳�������ö�Ӧ��Ԫ�ط��ű�ʾ������̬Dԭ�ӵĵ����Ų�ʽΪ ��
��2��A������������Ӧ��ˮ��������У�������ԭ�Ӳ�ȡ�ӻ���BC ![]() �Ŀռ乹��Ϊ����������������
�Ŀռ乹��Ϊ����������������
��3��1molAB���к��еĦм���ĿΪ ��
��4����ͼ�ǽ���Ca��D���γɵ�ij�ֺϽ�ľ����ṹʾ��ͼ����úϽ���Ca��D��ԭ�Ӹ������� ��
��5�������Ͻ��������Ͻ�����ͬ���͵ľ����ṹXYn �� �����к�ǿ�Ĵ�����������֪�����Ͻ�LaNin�������Ϊ9.0��10��23 cm3 �� ������γ�LaNinH4.5�Ͻ�����뾧����϶��������䣩����LaNin��n=������ֵ�������ںϽ��е��ܶ�Ϊ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com