
| A、2HBrO+Na2CO3═2NaBrO+H2O+CO2↑ |
| B、HBrO+Na2CO3═NaBrO+NaHCO3 |
| C、CO2+NaBrO+H2O═NaHCO3+HBrO |
| D、CO2+2NaBrO+H2O═Na2CO3+2HBrO |


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠粒与冷水反应:Na+2H2O═Na++2OH-+H2↑ | ||||
| B、硫酸氢钠溶液与氢氧化钡溶液混合后呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | ||||
| C、少量氢氧化镁固体溶于饱和的硝酸铵溶液中:2NH4++Mg(OH)2═2NH3?H2O+Mg2+ | ||||
D、实验室中将二氧化锰与浓盐酸共热:MnO2+4HCl(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CN-可以和稀硫酸反应生成HCN |
| B、CN-可被I2氧化成(CN)2 |
| C、在水溶液中(CN)2可被F-还原 |
D、HCN的电子式为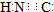 |
查看答案和解析>>
科目:高中化学 来源: 题型:
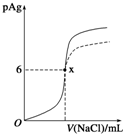 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图是向10mL AgNO3溶液中逐渐加入0.1mol?L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图是向10mL AgNO3溶液中逐渐加入0.1mol?L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A、原AgNO3溶液的物质的量浓度为0.1 mol?L-1 |
| B、图中x点的坐标为(100,6) |
| C、图中x点表示溶液中Ag+被恰好完全沉淀 |
| D、把0.1 mol?L-1的NaCl换成0.1mol?L-1NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=3 |
| B、x=2 |
| C、该样品高温条件下充分反应后剩余固体的质量是14.4 g |
| D、该样品高温条件下充分反应后剩余固体中MgO的质量是4.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将金属钠在研钵中研成粉末,以便钠与水反应的实验更安全 |
| B、用NaOH溶液浸泡铝箔,以除去其表面的氧化膜 |
| C、将10滴溴乙烷加到1 mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验溴乙烷是否发生了水解 |
| D、向新制的AgCl悬浊液中滴加KI溶液,有黄色沉淀生成,证明同温度下:Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com