
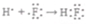 ②K2O
②K2O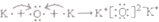
| A. | ①② | B. | ① | C. | ② | D. | 均不正确 |
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:实验题
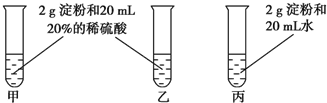 为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.
为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4→CuSO4 | B. | MnO4-→Mn2+ | C. | Fe→FeCl3 | D. | NaNO3→N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| B. | 任何条件下,等物质的量的乙烯(C2H4)和一氧化碳所含的分子数必然相等 | |
| C. | 10g一氧化碳气体和10g氧气的体积相等 | |
| D. | 同温同压下,等体积的物质所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.8 mol•L-1 | C. | 1.4 mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和铝 | B. | 锌和铝 | C. | 镁和铝 | D. | 铜和铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com