
(17分)电化学原理在日常生活和工农业生产中发挥着重要作用。钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:

(1)写出石墨电极的电极反应_________________________;
(2)将该装置作简单修改即可成为钢铁电化学防护的装置,请在上图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向且完成以下问题
①简单修改后的该防护装置的名称为__________________________________
写出修改后石墨电极的电极反应式____________________________________;
②_______极(填“正极”“负极”“阳极”“阴极”)附近溶液的pH增大;
③检验阳极产物的方法是_____________________________________________;
④修改后的装置共收集到标准状况下的气体11.2 L时,则有______mol电子发生转移,假设溶液的体积为200ml,则此时溶液中OH-的物质的量浓度为________ mol/L
(1)O2+2H2O+4e-===4OH-(2)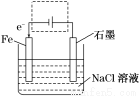 ;①外加电流的阴极保护法;2Cl- -2e-=Cl2↑;②阴极;③用湿润的淀粉KI试纸靠近阳极,如果试纸变蓝,说明是Cl2;④ 0.52.5
;①外加电流的阴极保护法;2Cl- -2e-=Cl2↑;②阴极;③用湿润的淀粉KI试纸靠近阳极,如果试纸变蓝,说明是Cl2;④ 0.52.5
【解析】
试题分析:(1)中性条件下,钢铁发生吸氧腐蚀,铁作负极,石墨作正极,正极上氧气得电子生成氢氧根离子,所以电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;(2)①要保护钢铁不受腐蚀,可以把铁设计成电解池的阴极,与电源负极相连接,名称为外加电源的阴极保护法;②阴极上氢离子得电子生成氢气,故阴极显碱性,PH增大;③电解质溶液为氯化钠溶液,石墨电极上有氯气生成,检验氯气的方法为用湿润的淀粉KI试纸靠近阳极,如果试纸变蓝,说明是Cl2 ;④11.2L气体的物质的量为0.5mol,生成氢气和氯气的总物质的量为0.5mol,生成氢气和氯气的物质的量分别为0.25mol,每生成1mol氢气转移2mol电子,故转移电子的物质的量为0.25molx2=0.5mol;转移电子数与阴极生成氢氧根离子的物质的量相等,故氢氧根离子的物质的量为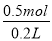 =2.5mol/L.,答案为:
=2.5mol/L.,答案为: ①外加电流的阴极保护法;2Cl- -2e-=Cl2↑;②阴极;③用湿润的淀粉KI试纸靠近阳极,如果试纸变蓝,说明是Cl2 ④ 0.5 2.5
①外加电流的阴极保护法;2Cl- -2e-=Cl2↑;②阴极;③用湿润的淀粉KI试纸靠近阳极,如果试纸变蓝,说明是Cl2 ④ 0.5 2.5
考点:原电池和电解池


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
设 NA为阿伏加德罗常数,下列有关叙述正确的是
A.78g过氧化钠晶体中,含NA个阴离子
B.56gFe 与稀 HN03 完全反应时一定转移3NA个电子
C.常温常压下,22.4L氦气含有NA个氦原子
D.已知热化学方程式2SO2(g)+O2(g) 2SO3(g)△H=-Q kJ?mol-1 (Q>0),则将 2NA 个SO2分子和 NA 个O2分子置于一密闭容器中充分反应后放出QkJ的热量
2SO3(g)△H=-Q kJ?mol-1 (Q>0),则将 2NA 个SO2分子和 NA 个O2分子置于一密闭容器中充分反应后放出QkJ的热量
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Mg2+、Na+、SO42-、Cl— B.K+、CO32-、Cl—、NO3—
C.NH4+、Na+、SO42-、NO3— D.Na+、K+、NO3—、SO32—
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
A.元素非金属性:Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>Y
C.气态氢化物的稳定性:Z<Y<X
D.原子半径:Z<Y<X
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.C CuO FeO
B.(NH4)2SO4 K2SO4 NH4Cl
C.Na2CO3 NaHCO3 K2CO3
D.AgNO3 KNO3 Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:Pb+ PbO2 + 2H2SO4 2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是
2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是
A.放电时PbO2是电池的负极
B.放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4
C.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强
D.充电时,该电池的正极接电源的负极
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:实验题
(15分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:

(1)第①步加稀H2SO4时,粗MnO2样品中的_________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:□ +□ +□ =□MnO2↓+□Cl2↑+□
+□ =□MnO2↓+□Cl2↑+□
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、________、________、________,
已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要________mol NaClO3。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期半期联考化学试卷(解析版) 题型:选择题
珍珠的主要成分是一种钙盐。将其加入稀盐酸中,有气泡产生,生成的气体无色无味,而且能使澄清石灰水变浑浊,则珍珠的主要成分是
A.CaSO4 B.CaCO3 C.CaCl2 D.Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com