
【题目】下列说法不正确的是( )
A. “臭氧空洞”、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
B. 工业海水制取镁流程:海水![]() Mg(OH)2→MgCl2
Mg(OH)2→MgCl2![]() Mg
Mg
C. 推广使用乙醇汽油代替汽油目的是为了减少温室气体的排放
D. 工业生产玻璃、水泥都用石灰石做原料
科目:高中化学 来源: 题型:
【题目】下列实验能说明燃烧不一定需要氧气的是( )
①氢气在氯气中燃烧;②镁在氯气中燃烧;③镁在二氧化碳中燃烧;④钠在氯气中燃烧
A.①B.②④C.③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)某同学依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示:
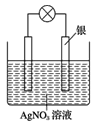
①负极发生的电极反应为___________;
②电解质溶液中的NO3-向__________电极移动;(写出电极材料的名称)
(2)当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是________;
(3)水是生命之源,也是化学反应中的主角。请回答下列问题:
已知:2mol H2完全燃烧生成液态水时放出572 kJ的热量。
①若2mol氢气完全燃烧生成水蒸气,则放出的热量______(填“>”“<”或“=”)572 kJ;
②每克氢气燃烧生成液态水时放出的热量为________;
(4)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。
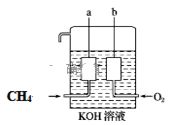
a电极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各为0.4mol。将A通入溴的四氯化碳溶液中,溶液褪色(反应原理与通入溴水一样),试回答:
(1)烃A的结构式为_________________________________。
(2)将A通入溴的四氯化碳溶液中,有关反应的方程式为_______________________。
(3)有机物B比A在分子组成上多一个CH2原子团,结构与A相似。写出B在一定条件下生成高分子化合物的化学方程式________________________________________________。
(4)写出苯与液溴反应的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素在周期表中的位置如图,则下列说法错误的是( )
![]()
A. 若Y的最简单氢化物的沸点比M的低,则X单质可与强碱溶液反应
B. 简单阴离子半径:M>Z>Y
C. 最高价氧化物对应水化物的酸性:Z>M
D. 若Y的氢化物的水溶液呈碱性,则X的氧化物不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com