
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
分析 A.AgNO3分别与NaCl、Na2SO4反应均生成白色沉淀;
B.四种物质之间均不反应;
C.FeCl3为黄色,与FeCl3反应生成红褐色沉淀的为NaOH,但不能鉴别NaCl、NaNO3;
D.NaHCO3与HCl反应生成气体,NaHCO3与NaAlO2反应生成白色沉淀,HCl与NaAlO2反应先生成沉淀后沉淀溶解.
解答 解:A.AgNO3分别与NaCl、Na2SO4反应均生成白色沉淀,现象相同,不能鉴别NaCl、Na2SO4,故A不选;
B.四种物质之间均不反应,现象相同,不能鉴别,故B不选;
C.FeCl3为黄色,与FeCl3反应生成红褐色沉淀的为NaOH,氯化铁、NaOH与另两种物质均不反应,不能鉴别NaCl、NaNO3,故C不选
D.NaHCO3与HCl反应生成气体,NaHCO3与NaAlO2反应生成白色沉淀,HCl与NaAlO2反应先生成沉淀后沉淀溶解,NaCl与其它三种物质均不反应,则可鉴别出各物质,故D选;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,CH3CH═CH2$→_{500℃}^{Cl_{2}}$
,CH3CH═CH2$→_{500℃}^{Cl_{2}}$ .以异戊二烯(
.以异戊二烯( 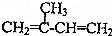 ),丙烯为原料合成
),丙烯为原料合成 .(用反应流程图表示,并注明反应条件)
.(用反应流程图表示,并注明反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:制氨气 | |
| B. | 实验Ⅱ:蒸发、浓缩、结晶 | |
| C. | 实验Ⅲ:配制1:1的稀硫酸 | |
| D. | 实验Ⅳ:用KMnO4标准溶液滴定未知浓度的Na2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2与水的反应:3NO2+H2O═2H++2NO3-+NO | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| C. | 醋酸溶液与水垢中的CaCO3反应:2H++CaCO3═Ca2++H2O+CO2↑ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com