
(1)0.5 mol CH4的质量是________g,在标准状况下的体积为________L;含________个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为________;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是________mL。
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A. 2 4 3 2 2 6 B. 0 2 1 0 1 2
C. 2 0 1 2 0 2 D. 2 2 2 2 1 4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下述三个实验均能发生化学反应。
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
下列判断正确的是( )
A. 实验①和③中的铁钉只作还原剂
B. 上述实验证明氧化性:Fe3+>Fe2+>Cu2+
C. 实验②中Fe2+既显氧化性又显还原性
D. 实验③中反应的离子方程式为Fe+Fe3+=2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.电离时能生成H+的化合物是酸
B.水溶液显碱性的物质是碱
C.电解质电离时产生的阴离子全部是OH-的化合物是碱
D.能与碱发生反应生成水的化合物是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在配制一定物质的量浓度的盐酸溶液时,下列错误操作可能使所配溶液浓度偏高的是( )
A.未将烧杯和玻璃棒的洗涤液移入容量瓶
B.溶解搅拌时液体飞溅
C.用量筒量取浓盐酸时,仰视读数
D.定容时水加多了,用滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图所示:
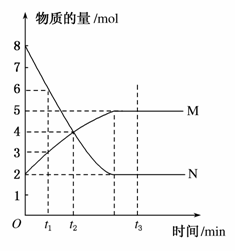
(1)此反应的化学方程式中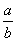 =________。
=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为______________________________________________________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A.反应中M与N的物质的量之比为11
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com