
科目:高中化学 来源: 题型:
元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液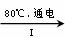 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□Na ClO3+□
ClO3+□ 。
。
②II中转化的基本反应类型是  ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是  (填离子符号)。
(填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不属于配合物的是( )
A.[Cu(H2O)4]SO4·H2O B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O D.Na3[AlF6]
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施对增大反应速率明显有效的是( )
A、Na与水反应时增大水的用量 B、Fe与稀硫酸反应制取氢气时,改用浓硫酸
C、在H2SO4与Na2CO3两溶液反应时,增大压强 D、反应N2+3H2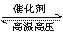 2NH3恒容增加氮气
2NH3恒容增加氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
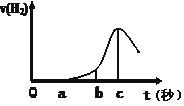 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是 (填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为 mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;② ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com