
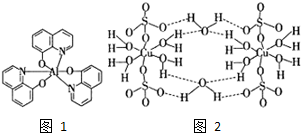
 2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.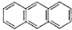 ,平面结构)属于非极性(填“极性”或“非极性”)分子.
,平面结构)属于非极性(填“极性”或“非极性”)分子.分析 (1)Cu+核外有28个电子,Cu原子失去1个电子生成Cu+,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式;
(2)正负电荷中心重合的分子为非极性分子;
(3)同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有空轨道和含有孤电子对的原子间形成配位键;
(4)A.根据价层电子对互斥理论确定其杂化方式;
B.非金属性越强的元素其电负性越大;
C.根据构成微粒确定其晶体类型;
D.结晶水不稳定,温度高时易失去;
(5)根据化合物各元素的化合价代数和为0确定铜的平均化合价,再利用十字相乘法确定+2价Cu和+3价Cu的原子个数之比.
解答 解:(1)Cu核外有29个电子,基态核外电子排布式1s22s22p63s23p63d104s1,故价电子排布式为3d10 4s1 ,故答案为:3d10 4s1
(2)正负电荷中心重合的分子为非极性分子,该分子是对称结构,正负电荷重心重合,所以是非极性分子,故答案为:非极性;
(3)由结构可知,含同种非金属元素C、C之间存在非极性键,含C、N非金属元素之间存在极性键,含有铝离子提供空轨道和O提供孤电子对的原子间形成配位键,所以其分子中存在的相互作用力有极性键、非极性键和配位键,故答案为:ABE;
(4)A.非金属性越强的元素其电负性越大,所以非金属性最强的是O元素,则电负性最大的是O元素,故正确;
B.该晶体的构成微粒是阴阳离子,属于离子晶体,故错误;
C.结晶水不稳定,温度高时易失去,故正确;
故选AC;
(5)根据化合物各元素的化合价代数和为0确定铜的平均化合价,铜的平均化合价=$\frac{6.95×2-3-2×2}{3}$=2.3,利用十字相乘法确定+2价Cu和+3价Cu的原子个数之比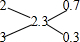 ,所以+2价Cu和+3价Cu的原子个数之比=0.7:0.3=7:3,故答案为:7:3.
,所以+2价Cu和+3价Cu的原子个数之比=0.7:0.3=7:3,故答案为:7:3.
点评 本题考查物质结构和性质,涉及核外电子排布式的书写、晶体类型的判断、晶胞的计算等知识点,这些都是高考热点,应注重基础知识的积累和掌握,难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的结构简式:C3H6 | |
| B. | Al3+能水解成Al(OH)3胶体,明矾可用作净水剂 | |
| C. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| D. | 盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 | |
| C. | “硝基苯制备”实验中,浓硫酸起到催化作用 | |
| D. | 用溴水验证裂化汽油中含有不饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A. | 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) | |
| B. | 平衡时,升高温度,Ⅰ中速率减慢,Ⅱ中速率加快 | |
| C. | 当密度不变时,上述反应即达平衡 | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 和Na2O | B. | MgCl2 和Na2S | C. | CaO和CO2 | D. | HCl 和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2 时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,降低温度 | |
| D. | Al与氧气燃烧生成Al2O3,将Al片改为Al粉, |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁丝在氯气燃烧 | B. | 过量的铁粉与溴水反应 | ||
| C. | 烧碱溶液吸收NO2 | D. | 硝酸铜受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com