
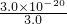 =10-20���õ�c��OH-��=10-10mol/L������ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=10-4mol/L����ҺpH=4����Cu��OH��2��ʼ����ʱ��Һ��pHΪ4��
=10-20���õ�c��OH-��=10-10mol/L������ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=10-4mol/L����ҺpH=4����Cu��OH��2��ʼ����ʱ��Һ��pHΪ4�� =8.0��10-33�����c��OH-��=2��10-11mol/L��ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=5��10-4mol/L����pH=3.3��ͨ�������֪��pH=4�ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ������У�
=8.0��10-33�����c��OH-��=2��10-11mol/L��ˮ��Һ�е����ӻ�c��H+����c��OH-��=10-14��c��H+��=5��10-4mol/L����pH=3.3��ͨ�������֪��pH=4�ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ������У�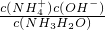 =
=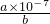 mol?L-1�����b=
mol?L-1�����b=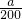 ��
��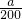 ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| a |
| 200 |
| a |
| 200 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�������ʡ�찲���и߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��10�֣���1���ڴ���CuSO4��5H2O�����г���������Fe2+�����ᴿʱΪ�˳�ȥFe2+�������������������ʹFe2+����ΪFe3+���������ʿɲ��õ���________
A. KMnO4 �� B. H2O2 ���� C. Cl2ˮ ���� D. HNO3
Ȼ���ټ����ʵ����ʵ�������ҺpH=4��ʹFe3+ת��ΪFe(OH)3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ�������ҺpH����ѡ�������е�________
A. NaOH B. NH3��H2O C. CuO D. Cu(OH)2
��2����ͬѧ���ɵ�������ҺpH=4�Ƿ��ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ���ͬѧ��Ϊ����ͨ������ȷ�����������й����ϵõ��������ݣ�������Fe(OH)3���ܶȻ�Ksp=8.0��10-38,Cu(OH)2���ܶȻ�Ksp=3.0��10-20��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5 mol��L-1ʱ����Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0 mol��L-1����Cu(OH)2��ʼ����ʱ��Һ��pHΪ________��Fe3+��ȫ����ʱ��Һ��pHΪ________��ͨ������ȷ����������________������С������С���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com