
分析 ①碘酒中的溶剂是酒精;
②微观粒子之间的间隔随着温度的升高而增大;
③铝的化学性质比较活泼,容易被氧气氧化成一层致密而坚硬的氧化物薄膜,从而对铝起到保护作用;
④豆腐、鸡蛋中含有丰富的蛋白质.
解答 解:①碘酒中的溶剂是酒精,酒精的化学式是C2H5OH.
故答案为:C2H5OH;
②炎热的夏季自行车车胎容易爆裂,原因是分子间的距离随温度升高而增大.
故答案为:分子间的距离随温度升高而增大;
③在通常情况下,铝能和氧气反应生成氧化铝,反应的化学方程式为:4Al+3O2═2Al2O3.
故答案为:4Al+3O2═2Al2O3;
④豆腐、鸡蛋中含有丰富的蛋白质.故答案为:豆腐、鸡蛋.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解 | |
| B. | 在有机物分子中,含有的氢原子个数一定是偶数 | |
| C. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| D. | 用溴水可以鉴别己烯、己烷、四氯化碳三种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
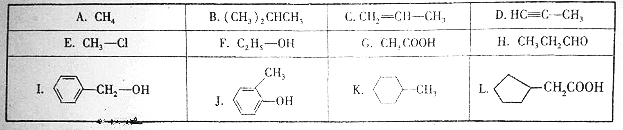
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用 | |
| B. | SO2可以用来漂白纸浆,也可以用来漂白银耳等食品 | |
| C. | 家中做卫生保洁时,不可将漂白粉与洁厕精(含浓盐酸)混合使用 | |
| D. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,但不能沉降水中的悬浮物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 阳极 | 白 | 红 | 蓝 | 蓝 |
| 阴极 | 蓝 | 蓝 | 红 | 蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H-H键无方向性 | |
| B. | 基态C原子有两个未成对电子,所以最多只能形成2个共价键 | |
| C. | 1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性所决定的 | |
| D. | 气体单质中,一定有σ键,可能有π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
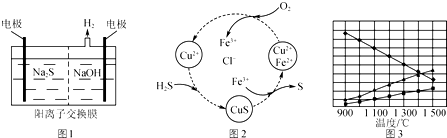
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com