
分析 计算NaCl的物质的量,根据化学方程式计算生成氯气、氢氧化钠物质的量,再根据V=nVm计算氯气体积,根据c=$\frac{n}{V}$计算NaOH的物质的量浓度.
解答 解:11.7g NaCl的物质的量为$\frac{11.7g}{58.5g/mol}$=0.2mol
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
2 2 1
0.2mol n(NaOH) n(Cl2)
所以n(Cl2)=$\frac{0.2mol×1}{2}$=0.1mol
n(NaOH)=$\frac{0.2mol×2}{2}$=0.2mol
则标况下生成氯气体积为0.1mol×22.4L/mol=2.24L,
所得NaOH的物质的量浓度为$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:在标准状况下制得Cl2为2.24L,所得NaOH的物质的量浓度为0.4mol/L.
点评 本题以氯碱工业为载体,考查化学方程式有关计算,比较基础,旨在考查学生对基础知识的理解掌握与应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 可以用碱石灰来干燥SO2气体 | |
| B. | 通入BaCl2溶液中,能生成白色沉淀 | |
| C. | 因为SO2有漂白性,所以它能使品红溶液、溴水褪色 | |
| D. | 将SO2气体通入装有品红溶液的试管里,红色逐渐褪去,给试管加热恢复红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂粉精溶液中通入过量的二氧化碳:ClO-+H2O+CO2═HClO+HCO3- | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 二氧化锰与浓盐酸反应:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+2Cl2↑, | |
| D. | 碳酸钙粉末与新制氯水反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
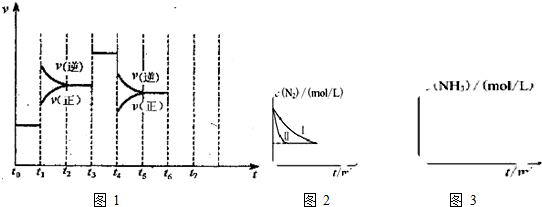
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
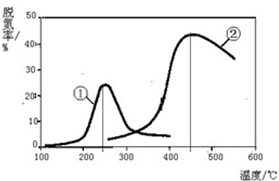 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
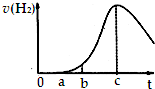 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com