
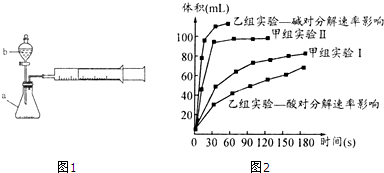
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2% H2O2 |
| 甲组实验Ⅱ | 25 | 10ml 5% H2O2 |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| M | M的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
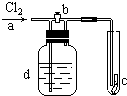 如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )
如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )| A、NaOH溶液 |
| B、浓H2SO4 |
| C、Ca(OH)2溶液 |
| D、食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①、② | B、①、③ |
| C、②、④ | D、②、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )
如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )| A、甲为NaHCO3,乙为Na2CO3 |
| B、要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球 |
| C、加热不久就能看到A烧杯中的澄清石灰水变浑浊 |
| D、整个实验过程中A烧杯中的澄清石灰水无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度,可逆反应正速率增大;减少反应物浓度,可逆反应逆速率增大 |
| B、粗铜精炼时,电解质液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的是电化学腐蚀 |
| D、阴极电保护法是将被保护的金属与外加电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com