
| A、CO2通入饱和碳酸钠溶液中 |
| B、在稀硫酸中加入铜粉,再加入KNO3固体 |
| C、NO2通入FeSO4溶液中 |
| D、SO2通入饱和CaCl2溶液中 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
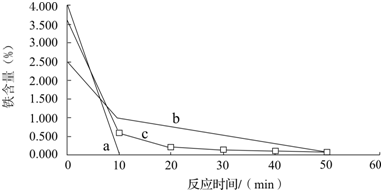
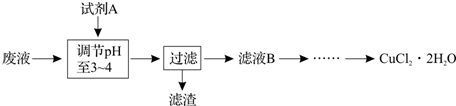
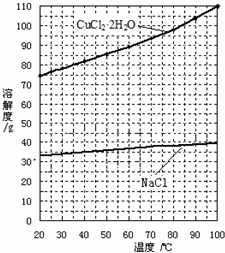
查看答案和解析>>
科目:高中化学 来源: 题型:
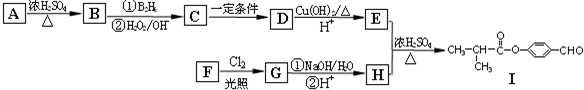
| ①B2H |
| ②H2O2/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
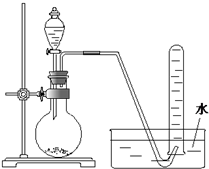
| A、用H2O2溶液和MnO2反应制取O2 |
| B、用浓盐酸和MnO2反应制取Cl2 |
| C、用稀硫酸与石灰石反应制取CO2 |
| D、用NH4Cl和Ca(OH)2反应制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数为9 |
| B、电负性是所有元素中最大的 |
| C、原子半径是同周期元素中最小的 |
| D、第一电离能是所有元素中最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
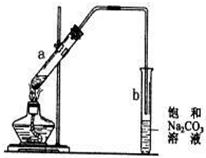
| A、在试管a中先加入2mL浓硫酸,不断摇动试管缓缓加入3mL乙醇和2mL冰醋酸 |
| B、b中导管末端不能插入液面是为了防倒吸 |
| C、实验结束后b试管底部会出现油状液体 |
| D、由于乙醇过量,实验结束后a中不再存在乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com