
| A、向Fe(NO3)3溶液中滴入少量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、向苯酚钠溶液中通入少量CO2气体:2C6H5O-+CO2+H2O-→2C6H5OH↓+CO32- |
| C、Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH- |
| D、澄清石灰水中加入少量NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、由水电离出来的c(H+)=10-12 mol?L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C、使甲基橙变红的溶液中:Fe2+、K+、NO3-、SO42- |
| D、使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO) |
| | =1 | =3 | =5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
| n(H2O) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡状态时,若c(CO)=0.100 mol?L-1,则c(CO2)=0.0263 mol?L-1 |
| B、若要提高CO的转化率,则应该加入适当的过量FeO |
| C、升高温度混合气体的平均相对分子质量不变 |
| D、若生成56gFe,则吸收的热量小于a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
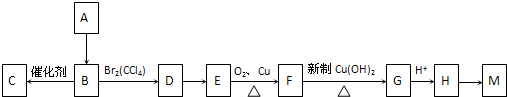
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W的金属性是同主族元素中最强的 |
| B、X、Z形成的化合物为离子化合物 |
| C、X最高价氧化物对应水化物的酸性大于Z的最高价氧化物对应水化物的酸性 |
| D、原子半径Y>Z,离子半径Y3+<Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com