
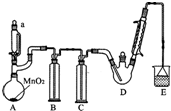
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
分析 A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(2)用饱和食盐水除去HCl;撤去B装置,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生;控制反应温度在70℃左右,应采取水浴加热;
(3)有机物易挥发性,冷凝回流挥发的有机物;E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,HCl与氢氧化钠反应生成氯化钠与水;
(4)CCl3COOH溶于乙醇与CCl3CHO;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算;
(6)a.酸性越强,电离程度越大,溶液pH越小;
b.电离程度越大,酸性越强,溶液中离子浓度越大,导电能力越强;
c.酸性越弱,其钠盐的水解程度越大,溶液pH越大.
解答 解:A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B装置用饱和食盐水除去HCl,减少副反应发生,撤去B装置,氯气中混有HCl,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生,导致装置D中副产物C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,
故答案为:饱和食盐水;C2H5Cl;水浴;
(3)有机物易挥发性,冷凝回流挥发的有机物;EE装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:冷凝回流;Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(4)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
(5)剩余I2的物质的量0.02000mol•L-1×0.02L×$\frac{1}{2}$=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol•L-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为$\frac{1.8×1{0}^{-3}mol×147.5g/mol}{0.4g}$×100%=66.4%,
故答案为:66.4%;
(6)a.酸性越强,电离程度越大,溶液pH越小;
b.电离程度越大,酸性越强,溶液中离子浓度越大,导电能力越强;
c.酸性越弱,其钠盐的水解程度越大,溶液pH越大.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故a正确;
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱,三氯乙酸溶液中离子浓度更大,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故b正确;
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大,说明乙酸钠的水解程度更大,则乙酸的酸性比三氯乙酸的弱,故c正确,
故选:abc.
点评 本题考查有机物制备、物质含量程度、实验方案设计等,关键是明确反应原理与各装置作用,掌握常用物质分离提纯方法,注意对题目信息的应用,难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+2Na-→2CH3CH2ONa+H2↑ | |
| B. | CH3COOCH2CH3+H2O$?_{△}^{稀硫酸}$CH3COOH+CH3CH2OH | |
| C. | CH2═CH2+Br2-→CH2BrCH2Br | |
| D. | 2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂的某些化合物是性能优异的材料.请回答:
锂的某些化合物是性能优异的材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式分别为C2H6和C4H10的两种有机化合物一定互为同系物 | |
| B. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变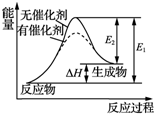 | |
| C. | 非金属氧化物一定是酸性氧化物 | |
| D. | 1 mol N2与3 mol H2在一定条件下充分反应可得2 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 放电时交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 放电后交换膜右侧溶液酸性增强 | |
| D. | 当电路中转移0.01 mol e-时交换膜左侧溶液中约减少0.01 mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com