
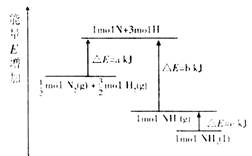
| A£®N2(g)+3H2(g)=2NH3(1); ”÷H=2(a-b-c)kJ”¤mol-1 |
| B£®N2(g)+3H2(g)=2NH3(g); ”÷H=2(b-a)kJ”¤mol-1 |
C£®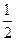 N2(g)+ N2(g)+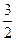 H2(g)=NH3(1); ”÷H=(b+c-a)kJ”¤mol-1 H2(g)=NH3(1); ”÷H=(b+c-a)kJ”¤mol-1 |
D£®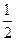 N2(g)+ N2(g)+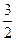 H2(g)=NH3(g); ”÷H=(a+b)kJ”¤mol-1 H2(g)=NH3(g); ”÷H=(a+b)kJ”¤mol-1 |
 ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Q2£½Q1£½197kJ | B£®Q1£¼Q2£¼197kJ | C£®Q2£¼Q1£¼197kJ | D£®Q1£½Q2£¼197kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

 C6H12O6£«6O2)ĪŖĪŅĆĒÉś“ęµÄ»·¾³³żČ„¶žŃõ»ÆĢ¼µÄÖŹĮæA”£ŹŌøł¾ŻÄÜĮæ¹ŲĻµĮŠ³öAµÄ¼ĘĖćŹ½”£
C6H12O6£«6O2)ĪŖĪŅĆĒÉś“ęµÄ»·¾³³żČ„¶žŃõ»ÆĢ¼µÄÖŹĮæA”£ŹŌøł¾ŻÄÜĮæ¹ŲĻµĮŠ³öAµÄ¼ĘĖćŹ½”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®A”śB£«CŗĶB£«C”śAĮ½øö·“Ó¦ĪüŹÕ»ņ·Å³öÄÜĮæ²»µČ |
| B£®A”śB£«C”÷H £¼ 0 |
| C£®A¾ßÓŠµÄģŹøßÓŚBŗĶC¾ßÓŠµÄģŹ×ÜŗĶ |
| D£®A”śB£«C”÷H £¾ 0£¬ŌņB£«C”śA”÷H £¼ 0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā







| A£®±łµÄĆܶȱČĖ®Š”£¬ÄÜø”ŌŚĖ®ĆęÉĻ |
| B£®½Ó½ü·ŠµćµÄĖ®ÕōĘųµÄĻą¶Ō·Ö×ÓÖŹĮæ²āĮæÖµ“óÓŚ18 |
| C£®ĮŚōĒ»ł±½¼×Č©µÄ·ŠµćµĶÓŚ¶ŌōĒ»ł±½¼×Č© |
| D£®H2O±ČH2SĪČ¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
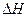 µÄ¾ų¶ŌÖµ¾łÕżČ·£©
µÄ¾ų¶ŌÖµ¾łÕżČ·£©| A£®C2H5OH£Øl£©+3O2£Øg£©==2CO2£Øg£©+3H2O£Øg£©£»”÷H=”Ŗ1367.0 kJ/mol£ØČ¼ÉÕČČ£© |
| B£®NaOH£Øaq£©+HCl£Øaq£©==NaCl£Øaq£©+H2O£Øl£©£»”÷H=+57.3kJ/mol£ØÖŠŗĶČČ£© |
| C£®S£Øs£©+O2£Øg£©===SO2£Øg£©£»”÷H=”Ŗ269.8kJ/mol£Ø·“Ó¦ČČ£© |
| D£®2NO2==O2+2NO£»”÷H=+116.2kJ/mol£Ø·“Ó¦ČČ£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Č¼ÉÕ²»Ņ»¶ØÓŠŃõĘų²Ī¼Ó£¬Ņ²²»Ņ»¶ØŹĒ·ÅČČ·“Ó¦ |
| B£®»š¼żµć»šŗó£¬Åē³öµÄŗģÉ«»šŃęŹĒ½šŹōµÄŃęÉ«·“Ó¦²śÉśµÄ |
| C£®»š¼żČ¼ĮĻČ¼ÉÕÖ÷ŅŖŹĒ½«»ÆѧÄÜ×Ŗ±äĪŖČČÄÜŗĶ¹āÄÜ£¬æÉÄܶŌ»·¾³²śÉśĪŪČ¾ |
| D£®Ę«¶ž¼×ėĀČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ŹĒ£ŗC2H8N2(g)+2N2O4(g)=2N2(g)+2CO2(g)+4H2O(g)£»”÷H=-2550kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£®øɱłÕō·¢ŅŖĪüŹÕ“óĮæµÄČČ£¬Õāøö±ä»ÆŹĒĪüČČ·“Ó¦ |
| B£®¾Ę¾«æÉ×÷Č¼ĮĻ£¬ĖµĆ÷¾Ę¾«Č¼ÉÕŹĒ·ÅČČ·“Ó¦ |
| C£®Ä¾ĢæŠč¼ÓČȵ½Ņ»¶ØĪĀ¶Č²ÅČ¼ÉÕ£¬¹ŹÄ¾ĢæČ¼ÉÕŹĒĪüČČ·“Ó¦ |
| D£®ÓĆĒāŃõŃęæÉŗø½Ó½šŹō£¬Ö÷ŅŖŹĒĄūÓĆĒāĘųŗĶŃõĘų»ÆŗĻŹ±·Å³ö“óĮæµÄČČ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com