
【题目】气体制备时须先检查装置的气密性,下列各图所示操作,符合气密性检查要求的是__________
A. 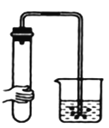 B.
B. 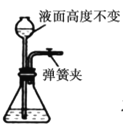 C.
C. 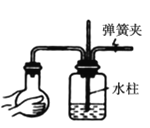 D.
D. 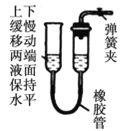
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示两套实验装置,分别回答下列问题。
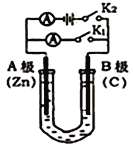
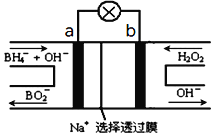
图1 图2
(1)如图1所示,U形管内盛有100mL的溶液,
①打开K2,闭合K1,若所盛溶液为CuSO4溶液:则B极的电极反应式为_______________________。
②打开K1,闭合K2,若所盛溶液为MgCl2溶液,则可观察到的现象是_________________________,总反应化学方程式是_________________________________。
③如要用电解方法精炼粗镍(元素符号Ni),打开K1,闭合K2,电解液选用NiSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Ni2+浓度_____(填“增大”、“减小”、“不变”)。
(2)图2装置为硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。
①电池的负极反应式为__________________________
②放电时,每转移2mol电子,理论上需要消耗_________g NaBH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A.参加反应的Fe2+全部作还原剂
B.每生成1 mol Fe3O4,被S2O32-还原的O2为0.5 mol
C.x=3
D.已知Fe3O4纳米颗粒直径为20 nm,则Fe3O4纳米颗粒为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往一体积不变的密闭容器中充入H2和I2,发生反应 H2(g)+I2(g)![]() 2HI(g);△H>0达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
2HI(g);△H>0达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度不变
C.由于压强增大,导至H2,I2(g),HI平衡浓度都增大
D.改变的条件是升温,速率图象为下图

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
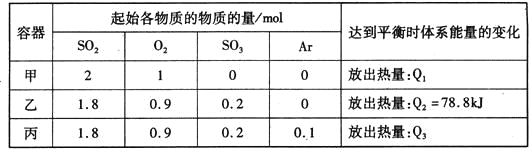
下列叙述正确的是
A. Q1>Q3>Q2=78.8kJ
B. 三个容器中反应的平衡常数均为K=2
C. 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D. 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16gCH4所含中子数目为8NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴已知在周期表的某一周期,其零族元素的价层电子排布式为![]() ,同周期的A、B两种元素,最外层电子数为2、7,次外层电子数为8、18,则元素A为________,B为________(写元素符号)。若周期表有第8周期,则其最终的零族元素的原子序数为____________。
,同周期的A、B两种元素,最外层电子数为2、7,次外层电子数为8、18,则元素A为________,B为________(写元素符号)。若周期表有第8周期,则其最终的零族元素的原子序数为____________。
⑵稀有气体的化合物![]() 分子的空间构型是__________,写出与其互为等电子体的一种阴离子的化学式___________。
分子的空间构型是__________,写出与其互为等电子体的一种阴离子的化学式___________。
⑶硼酸能形成类似于石墨的层状结构,单层的结构如图所示
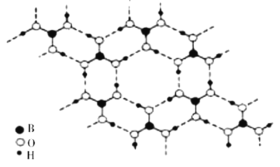
则硼酸晶体中存在的作用力除共价键外,还有_____________。
⑷稀土资源是重要的战略资源,下图为某稀土元素A的氧化物晶体的立方晶胞结构示意图,其中氧离子占据顶点、面心、棱心、体心的位置,A离子占据半数的立方体空隙
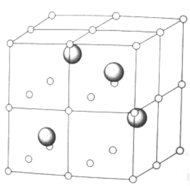
写出A氧化物的化学式______,A离子的配位数为______。已知晶胞参数为![]() ,则
,则![]() 间距为________
间距为________![]() ,设A的摩尔质量为
,设A的摩尔质量为![]() ,晶体的密度为_______
,晶体的密度为_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有FeSO4、Fe(NO3)3、Al(NO3)3、NH4Cl、 Na2CO3 中的几种,进行如下实验:
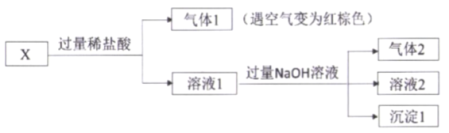
下列说法不正确的是
A.混合物X中必定含有NH4Cl、FeSO4,不含Na2CO3
B.灼烧沉淀1,可以得到红棕色物质
C.将足量的气体2通入溶液1中,将出现沉淀
D.往溶液2中通入足量的CO2,若没有出现沉淀,说明X中不含Al(NO3)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com