
��6�֣�����գ�
I����֪��CO2+3H2O+2AlO2��===2Al(OH)3��+CO32����
��NaAlO2��Һ�г��������CO2���壬��д�������Ļ�ѧ��Ӧ����ʽ�� ��
II������Ũ��Ϊ0.1 mol?L��1�����ֵ������Һ��
�� Na2CO3 �� NaHCO3 �� NaAlO2 �� CH3COONa �� NaOH
��1����������Һ��pH��С�����˳����___ �����ţ���
��2����������Һϡ����ͬ�ı���ʱ����pH�仯������______�����ţ���
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
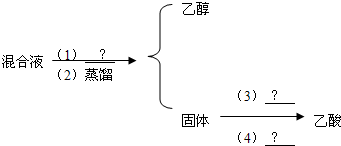 I����ѹ���Ҵ��ķе�Ϊ78.5�棬����ķе�Ϊ118�棬�����Ƿ����Ҵ�������ķ����������[��1����3����ҩƷ����2����4���Dz�������]
I����ѹ���Ҵ��ķе�Ϊ78.5�棬����ķе�Ϊ118�棬�����Ƿ����Ҵ�������ķ����������[��1����3����ҩƷ����2����4���Dz�������]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
TiO2�ڹ�ҵ�������ճ�����������Ҫ��;��
I����ҵ�����ѿ�ʯ��FeTiO3����FeO��Al2O3��SiO2�����ʣ�����������Ӧ�Ƶã�
���У�����ڷ����ķ�ӦΪ��2H2SO4��FeTiO3=TiOSO4��FeSO4��2H2O��
��1�������ѿ�ʯʱ���Ƿ���Ҫ��ȥ����FeO���� �����Ҫ������Ҫ������
��2�������ѿ�ʯʱ������Ũ����������Һ��������д���ù����з�����Ӧ�Ļ�ѧ����ʽ��
�� ��
II��TiO2��ͨ���������ַ����Ʊ������ѣ�
������һ���ǵ��TiO2�����Ti��ͬʱ����O2��������������TiO2��������ʯīΪ����������CaCl2Ϊ���Һ����̼�������۳ء�
��3��������Ӧ�ĵ缫��ӦʽΪ___________________________________��
��4�����������趨������۳��м���̼���ԭ����______________________��
�������������Ƚ�TiO2��Cl2��C��Ӧ�õ�TiCl4������þ��ԭ�õ�Ti����������Ӧ���ڷ�����
TiO2 (s)��2Cl2 (g)TiCl4(l)��O2(g) ��H=��151 kJ��mol��1
���Բ���ֱ���� TiO2 �� Cl2 ��Ӧ�����Ȼ���Ӧ������ȡTiCl4�������Ȼ���Ӧ��ϵ�м���̼��̼��������Ӧ������ϣ�ʹ�÷�Ӧ�ڸ�����������˳�����С�
��5����֪��C(s)��O2 (g) =CO2 (g) ��H=��394 kJ��mol��1������գ�
TiO2 (s)��C(s)��2Cl2 (g) = TiCl4 (l)��CO2(g) ��H= ______________
��6���ӻ�ѧƽ��ĽǶȽ��ͣ����Ȼ���Ӧ��ϵ�м���̼ʱ���Ȼ���Ӧ��˳�����е�ԭ��
��____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꼪��һ�и�����̣������ۺϣ���ѧ���� ���ͣ������
TiO2�ڹ�ҵ�������ճ�����������Ҫ��;��
I����ҵ�����ѿ�ʯ��FeTiO3����FeO��Al2O3��SiO2�����ʣ�����������Ӧ�Ƶã�
���У�����ڷ����ķ�ӦΪ��2H2SO4��FeTiO3=TiOSO4��FeSO4��2H2O��
��1�������ѿ�ʯʱ���Ƿ���Ҫ��ȥ����FeO���� �����Ҫ������Ҫ������
��2�������ѿ�ʯʱ������Ũ����������Һ��������д���ù����з�����Ӧ�Ļ�ѧ����ʽ��
�� ��
II��TiO2��ͨ���������ַ����Ʊ������ѣ�
������һ���ǵ��TiO2�����Ti��ͬʱ����O2��������������TiO2��������ʯīΪ����������CaCl2Ϊ���Һ����̼�������۳ء�
��3��������Ӧ�ĵ缫��ӦʽΪ___________________________________��
��4�����������趨������۳��м���̼���ԭ����______________________��
�������������Ƚ�TiO2��Cl2��C��Ӧ�õ�TiCl4������þ��ԭ�õ�Ti����������Ӧ���ڷ�����
TiO2 (s)��2Cl2 (g) TiCl4(l)��O2 (g) ��H=��151 kJ��mol��1
TiCl4(l)��O2 (g) ��H=��151 kJ��mol��1
���Բ���ֱ����TiO2 ��Cl2��Ӧ�����Ȼ���Ӧ������ȡTiCl4�������Ȼ���Ӧ��ϵ�м���̼��̼��������Ӧ������ϣ�ʹ�÷�Ӧ�ڸ�����������˳�����С�
��5����֪��C(s)��O2 (g) = CO2 (g) ��H=��394 kJ��mol��1������գ�
TiO2 (s)��C (s)��2Cl2 (g) = TiCl4 (l)��CO2 (g) ��H= ______________
��6���ӻ�ѧƽ��ĽǶȽ��ͣ����Ȼ���Ӧ��ϵ�м���̼ʱ���Ȼ���Ӧ��˳�����е�ԭ��
��____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ�긣��ʡ����һ�С����и�һ��ѧ��������ѧ�Ծ� ���ͣ�ʵ����
����12�֣�I.��6�֣���ѹ���Ҵ��ķе�Ϊ78.5�棬����ķе�Ϊ118�棬�����Ƿ����Ҵ�������ķ����������[(1)(3)��ҩƷ����2����4���Dz�������]
��գ���1�� ��3�� ��4��
|

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꼪��һ�и�����̣������ۺϣ���ѧ���� ���ͣ������
TiO2�ڹ�ҵ�������ճ�����������Ҫ��;��
I����ҵ�����ѿ�ʯ��FeTiO3����FeO��Al2O3��SiO2�����ʣ�����������Ӧ�Ƶã�

���У�����ڷ����ķ�ӦΪ��2H2SO4��FeTiO3=TiOSO4��FeSO4��2H2O��
��1�������ѿ�ʯʱ���Ƿ���Ҫ��ȥ����FeO���� �����Ҫ������Ҫ������
��2�������ѿ�ʯʱ������Ũ����������Һ��������д���ù����з�����Ӧ�Ļ�ѧ����ʽ��
�� ��
II��TiO2��ͨ���������ַ����Ʊ������ѣ�
������һ���ǵ��TiO2�����Ti��ͬʱ����O2��������������TiO2��������ʯīΪ����������CaCl2Ϊ���Һ����̼�������۳ء�
��3��������Ӧ�ĵ缫��ӦʽΪ___________________________________��
��4�����������趨������۳��м���̼���ԭ����______________________��
�������������Ƚ�TiO2��Cl2��C��Ӧ�õ�TiCl4������þ��ԭ�õ�Ti����������Ӧ���ڷ�����
TiO2 (s)��2Cl2 (g) TiCl4(l)��O2
(g) ��H=��151 kJ��mol��1
TiCl4(l)��O2
(g) ��H=��151 kJ��mol��1
���Բ���ֱ���� TiO2 �� Cl2 ��Ӧ�����Ȼ���Ӧ������ȡTiCl4�������Ȼ���Ӧ��ϵ�м���̼��̼��������Ӧ������ϣ�ʹ�÷�Ӧ�ڸ�����������˳�����С�
��5����֪��C(s)��O2 (g) = CO2 (g) ��H=��394 kJ��mol��1������գ�
TiO2 (s)��C (s)��2Cl2 (g) = TiCl4 (l)��CO2 (g) ��H= ______________
��6���ӻ�ѧƽ��ĽǶȽ��ͣ����Ȼ���Ӧ��ϵ�м���̼ʱ���Ȼ���Ӧ��˳�����е�ԭ��
��____________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com