
| A. | 盐酸跟氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 硝酸跟碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| C. | 氯化钠溶液跟硝酸银溶液反应:Ag++Cl-═AgCl↓ | |
| D. | 盐酸跟氢氧化铜反应:H++OH-═H2O |
分析 A.反应生成氯化钠和水;
B.反应生成硝酸钠、水、二氧化碳;
C.反应生成氯化银和硝酸钠;
D.氢氧化铜在离子反应中保留化学式.
解答 解:A.盐酸跟氢氧化钠溶液反应的离子反应为H++OH-═H2O,故A正确;
B.硝酸跟碳酸钠溶液反应的离子反应为2H++CO32-═CO2↑+H2O,故B正确;
C.氯化钠溶液跟硝酸银溶液反应的离子反应为Ag++Cl-═AgCl↓,故C正确;
D.盐酸跟氢氧化铜反应的离子反应为2H++Cu(OH)2═Cu2++2H2O,故D错误;
故选D.
点评 本题考查离子方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;
;| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
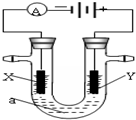 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是银白色、质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl的金属性强于铝 | D. | 能与硝酸反应放出H2并生成硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
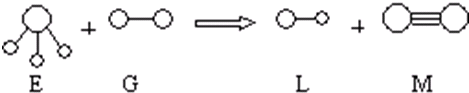
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
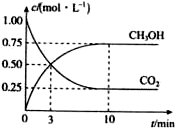 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)$\frac{\underline{\;高温\;}}{\;}$CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入l mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1.下列叙述中不正确的是( )
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)$\frac{\underline{\;高温\;}}{\;}$CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入l mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1.下列叙述中不正确的是( )| A. | 0~3 min内,v(CO2)正=v(CH3OH)正 | |
| B. | 在T1℃时,若起始时向容器中充人2 moI CO2和6 mol H2,测得平衡时容器内压强为p2,则p2<2p1 | |
| C. | 其他条件不变,若向平衡后的体系中充人1 mol氦气,体系压强增大,平衡将向正反应方向移动 | |
| D. | T2℃时,上述反应平衡常数为4.2,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
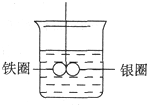 如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com