
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案: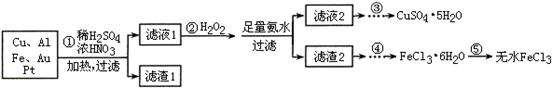
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
(1)Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O 3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O (任写一个给2分)
3Cu2++2NO↑+4H2O (任写一个给2分)
(2)将Fe2+氧化成Fe3+ (1分) Fe(OH)3、Al(OH)3 (各1分共2分)
(3)FeCl3易水解:FeCl3+3H2O 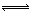 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分)
Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分)
(4) 5 (2分)
(5)溶液由蓝色褪为无色且半分钟内不恢复原色 (2分) 83.3% (2分)
解析试题分析:(1)浓硝酸与稀硫酸混合后,可能为浓硝酸也可能为稀硝酸,所以离子方程式为:Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O或3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
(2)H2O2具有强氧化性,所以H2O2的作用是将Fe2+氧化成Fe3+;加入足量氨水,Fe3+、Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,所以滤渣2为Fe(OH)3、Al(OH)3。
(3)FeCl3为强酸弱碱盐,容易发生水解反应:FeCl3+3H2O 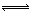 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
(4)c2(OH?)?c(Cu2+)= Ksp[Cu(OH)2],代入数据可求出c(OH?)=1.0×10-9mol?L?1,pH=-lgc(H+)=-lg【Kw÷c(OH?)】=5。
(5)Cu2+把I?氧化为I2,加入淀粉溶液变蓝,用Na2S2O3标准溶液滴定,达到滴定终点时,Na2S2O3与I2恰好完全反应,所以达到滴定终点的依据是:溶液由蓝色褪为无色且半分钟内不恢复原色;实验3所测数据明显大于其他3组数据,说明实验3出现了实验错误,应舍去,根据其他3组数据求出平均值,根据2Cu2++4I-= 2CuI↓+I2和I2+2S2O32-= 2I-+S4O62-可得对应关系:S2O32- ~ Cu2+,所以n(CuSO4?5H2O)=n(Cu2+)=n(S2O32- )=0.080 mol·L-1 ×(25.00+25.02+24.98)/3L=0.002mol,所以此产品中CuSO4·5H2O的质量分数为:0.002mol×250g/mol×5÷3.00g×100%=83.3%
考点:本题考查化学流程的分析、化学方程式的书写、盐类水解的应用、pH的计算、氧化还原反应滴定及计算。


科目:高中化学 来源: 题型:填空题
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。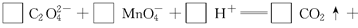
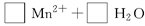
(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+ Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 。
(2)写出CuH在氯气中燃烧的化学反应方程式
(3)CuH溶解在稀盐酸中生成的气体是 ,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO42-发生反应,生成MnO4-和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是________________。
(3)把KI换成KBr,则CCl4层变成________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为25.4mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH= .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为: 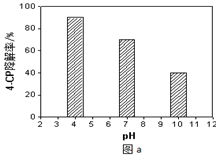

(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是______,反应产生的气体可用______吸收。
(3)As2S3和HNO3有如下反应: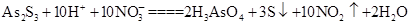 ,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的C反应,所产生的CO2的量______(选填编号)。
a.小于0.5 mol
b.等于0.5 mol
c.大于0.5 mol
d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCl(浓)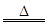 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)反应物中,氧化剂是________;化合价升高的元素是________。
(2)取一定体积的浓盐酸与MnO2发生反应,产生的氯气在标准状况下的体积为1.12 L(忽略Cl2的溶解)。则参加反应的HCl的物质的量是________;反应中被氧化的HCl的质量是________。(写出简要解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)若有71gCl2参加反应,被氧化的物质是 ;转移电子的物质的量为 mol。
(2)反应后,若产生14g N2,则有 g NH3被氧化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com