
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
分析 n(H2)=$\frac{0.1g}{2g/mol}$=0.05mol,令金属与盐酸反应都是+1价,根据转移电子守恒得n(金属)=2n(H2)=2×0.05mol=0.1mol,则混合金属的平均摩尔质量=$\frac{3g}{0.1mol}$=30g/mol,则平均相对原子质量为30,据此分析解答.
解答 解:n(H2)=$\frac{0.1g}{2g/mol}$=0.05mol,令金属与盐酸反应都是+1价,根据转移电子守恒得n(金属)=2n(H2)=2×0.05mol=0.1mol,则混合金属的平均摩尔质量=$\frac{3g}{0.1mol}$=30g/mol,则平均相对原子质量为30,因为没有金属相对原子质量为30的,所以两种金属一种相对原子质量大于30、一种相对原子质量小于30,
A.Li、Na元素相对原子质量都小于30,所以不符合条件,故A选;
B.Rb相对原子质量大于30、+1价Ca元素(+1价时其相对原子质量为20)的相对原子质量为20,符合条件,故B不选;
C.Na元素相对原子质量小于30、+1价Cu元素相对原子质量大于30,符合条件,故C不选;
D.K的相对原子质量大于30、Na元素的相对原子质量小于30,符合条件,故D不选;
故选A.
点评 本题考查混合物的计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,采取平均量进行判断,注意Ca、Cu元素转化为+1价时其相对原子质量,为易错点.


科目:高中化学 来源: 题型:解答题
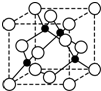 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: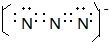 ;
;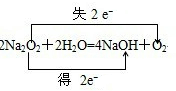 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | 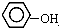 与 与 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
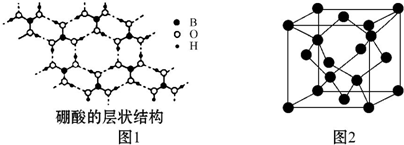
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③⑤ | B. | ④①②③⑤ | C. | ⑤③②①④ | D. | ④①③⑤② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加大CaCO3的量 | B. | 加大盐酸的浓度 | ||
| C. | 及时将产生的CO2导出 | D. | 减小CaCl2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
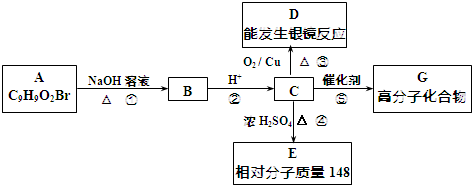
 .
.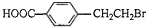 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.
+NaBr+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3<PH3<AsH3 | B. | 离子半径:阴离子>阳离子 | ||
| C. | 熔沸点:离子化合物>共价化合物 | D. | 酸性:H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com