
| A. | 二氧化碳能灭火,所以燃着的镁条在二氧化碳中便熄灭 | |
| B. | 硬铝的硬度比铝大,熔点比铝低 | |
| C. | 相同质量的铜分别跟足量的浓硝酸或稀硝酸反应,产生气体的体积比为1:1 | |
| D. | 相同质量的铝分别跟足量的稀盐酸酸或氢氧化钠溶液共热,产生气体体积相同 |
分析 A.燃着的镁条与二氧化碳发生化学反应;
B.合金的硬度一般比组分金属的大,熔点一般比组成金属的低;
C.根据3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O分析;
D.根据2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2Al+6HCl═2AlCl3+3H2↑分析.
解答 解:A.燃着的镁条与二氧化碳发生化学反应,因此不会熄灭,故A错误;
B.合金的硬度一般比组分金属的大,熔点一般比组成金属的低,故B正确;
C.一定质量的铜分别与足量的稀硝酸和浓硝酸完全反应,发生3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,等量的Cu与酸反应,浓硝酸反应生成气体多,故C错误;
D.由2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2Al+6HCl═2AlCl3+3H2↑可知,2molAl分别与足量酸、碱反应都生成3molH2,则两份等量的铝粉分别与足量酸、碱反应生成等量的氢气,氢气的物质的量之比等于其体积之比,则相同状态下产生的气体体积之比是1:1,故D正确;
故选BD.
点评 本题考查了元素及其重要化合物的性质,关键是清楚发生的化学反应,可以利用电子转移守恒判断,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 在难溶电解质的饱和溶液中,电解质的Ksp越小,其物质的量浓度越小 | |
| D. | 反应5S2O82-+2Mn2++8H20═10SO42-+2MnO4-+16H+,得电子的元素是氧元素,反应中转移10e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
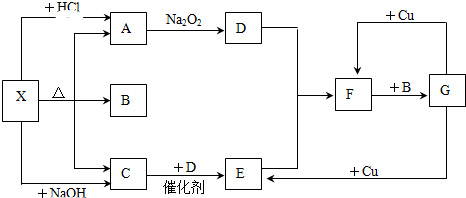
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
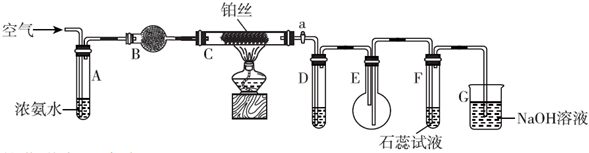
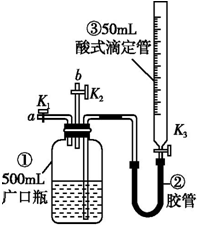 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com