
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.常温常压下,28g的乙烯和丙烯混合气体含有的分子数为NA
B.任意条件下,1mol苯中含C﹣H键的数目一定为6NA
C.标准状况下,1L乙醇完全燃烧产生CO2分子的数目为![]() ×2
×2
D.1molCH3+中含有电子数为9NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
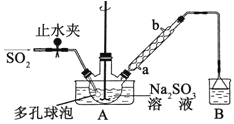
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,搅拌(防止生成沉淀覆盖在锌粉表面阻止反应进行),反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
⑴装置B 的烧杯中应加入的溶液是__________________________________________。
⑵A中多孔球泡的作用是_______________________________________________。
⑶冷凝管中回流的主要物质除H2O 外还有__________________________(填化学式)。
⑷写出步骤2中发生反应的化学方程式____________________________。
⑸步骤3中在真空容器中蒸发浓缩的原因是__________________________________。
⑹①抽滤时使用如下装置,其中a和b的名称分别__________、 __________。中途停止抽滤时应 ___________________________以防倒吸。
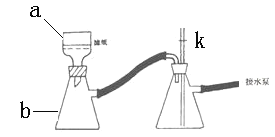
②如果抽滤的溶液具有强氧化性时,可采取_________________________________的措施
⑺为了测定产品的纯度,准确称取2.000g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的化学式为C5H11Cl,已知:分子中有两个—CH3、两个-CH2-、一个![]() 和一个-Cl,它的可能的结构有几种
和一个-Cl,它的可能的结构有几种
A. 2B. 3C. 4D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
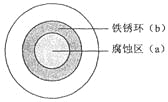
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物B,俗名水杨酸,其结构简式为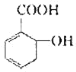 ,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.利用浓硝酸与蛋白质的颜色反应,可鉴别含有苯环的蛋白质
B.用新制氢氧化铜可以鉴别丙三醇、丙醛、丙酸
C.甘氨酸可以以![]() 的形式从水溶液中结晶析出
的形式从水溶液中结晶析出
D.除去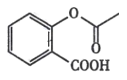 中的杂质
中的杂质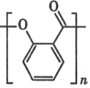 :加足量饱和NaHCO3溶液 ,过滤
:加足量饱和NaHCO3溶液 ,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.治疗胃酸过多的药物达喜(其式量不超过 700)由五种短周期元素组成,按如下流程进行实验以确定其组成。
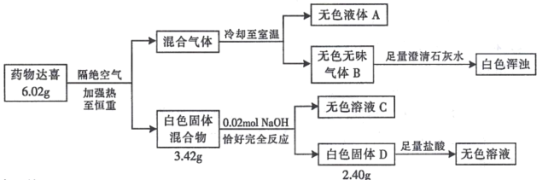
请回答:
(1)达喜的化学式是_____________。
(2)达喜与胃酸(含稀盐酸)反应的化学方程式是____________。
(3)气体 B 与环氧丙烷(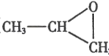 )可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
)可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
II.将 NaC1O3 溶液逐滴加入到碘单质和过量盐酸的混合液中可制备液态 ICl,实验装置如下图:
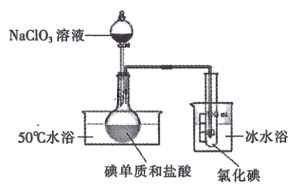
请回答:
(1)圆底烧瓶中发生的化学反应是______________( 用化学方程式表示)。
(2)若加入的 NaClO3 溶液已足量,请设计实验方案证明该反应已完全:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com