
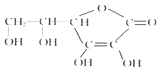 维生素C的结构简式如图所示:
维生素C的结构简式如图所示:分析 (1)由维生素C的结构简式可得分子式;
(2)维生素C属于水溶性维生素;
(3)维生素C具有较强的还原性,能被碘氧化;
(4)新鲜的水果、蔬菜中富含维生素C.
解答 解:(1)由维生素C的结构简式可得维生素C的分子式为C6H8O6,
故答案为:C6H8O6;
(2)维生素C属于水溶性维生素,因此维生素C易溶于水,不溶于有机溶剂,
故答案为:易;
(3)维生素C是一种抗氧化剂,具有较强的还原性,能被碘氧化,因此能使碘水褪色,
故答案为:能;还原;
(4)辣椒中富含维生素C,鸡蛋中富含蛋白质,米饭中富含糖类物质,青霉素不是人体中的营养物质,
故答案为:A.
点评 本题考查人体必需维生素的主要来源及摄入途径,题目难度不大,掌握维生素C的理化性质是解题的关键.


科目:高中化学 来源: 题型:选择题

| A. | b电极为该电池的负极 | |
| B. | b电极附近溶液的pH减小 | |
| C. | a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | a交换膜为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
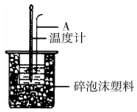 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
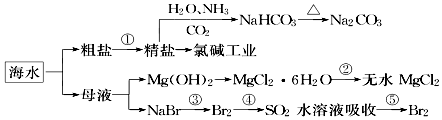 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:水玻璃、碱石灰、明矾 | B. | 酸:稀硫酸、次氯酸、硫酸氢钠 | ||
| C. | 酸性氧化物:SO2、CO2、SiO2 | D. | 碱性氧化物:CaO、Na2O2、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com