
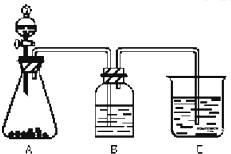
 为了确认CH3COOH、H2CO3和H2SiO3的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液).
为了确认CH3COOH、H2CO3和H2SiO3的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液).| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石蕊层仍为紫色 |
| B、石蕊层有两层,上层为紫色,下层为蓝色 |
| C、石蕊层为三层环,由上而下是蓝色、紫色、红色 |
| D、石蕊层为三层环,由上而下是红色、紫色、蓝色. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
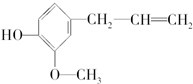 某有机物的结构简式如图,关于该物质的下列说法:①能和溴水发生取代反应 ②能发生消去反应 ③能发生氧化反应 ④能发生加成反应 ⑤能发生水解反应,其中不正确的是( )
某有机物的结构简式如图,关于该物质的下列说法:①能和溴水发生取代反应 ②能发生消去反应 ③能发生氧化反应 ④能发生加成反应 ⑤能发生水解反应,其中不正确的是( )| A、①③ | B、②⑤ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Na+、Ba2+、Cl- |
| B、Na+、I-、HCO3-、SO42- |
| C、K+、Cl-、SO32-、AlO2- |
| D、Na+、Mg2+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com