

分析 (1)已知:①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)?CH3OH(g),反应热也进行相应计算;
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢;
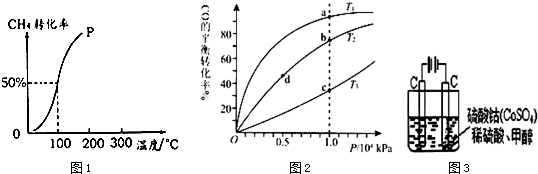
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,正反应为气体物质的量减小的反应,压强越大,越有利于平衡向正反应进行;
②由图象可知,在100℃P1时,CO的转化率是0.5,则:
CO(g)+2H2(g)=CH3OH(g)
起始浓度(mol/L):$\frac{a}{V}$ $\frac{2a}{V}$ 0
转化浓度(mol/L):$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
平衡浓度(mol/L):$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
所以平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;
③在其它条件不变的情况下,再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大;
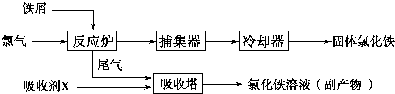
(4)①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,所以阳极是HSO3-溶液失去电子被氧化生成SO42-.
解答 解:(1)已知:①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)?CH3OH(g),则△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为:-90.1;
(2)a.使用高效催化剂,反应速率加快,故a正确;
b.降低反应温度,反应速率减慢,故b错误;
c.增大体系压强,物质的浓度增大,反应速率加快,故c正确;
d.不断将CH3OH从反应混合物中分离出,浓度减小,反应速率减慢,故d错误,
故选:ac;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,正反应为气体物质的量减小的反应,压强越大,越有利于平衡向正反应进行,故压强P1<P2,
故答案为:小于;
②由图象可知,在100℃P1时,CO的转化率是0.5,则:
CO(g)+2H2(g)=CH3OH(g)
起始浓度(mol/L):$\frac{a}{V}$ $\frac{2a}{V}$ 0
转化浓度(mol/L):$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
平衡浓度(mol/L):$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
所以平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{a}{2V}}{\frac{a}{2V}×(\frac{a}{V})^{2}}$=$\frac{{V}^{2}}{{a}^{2}}$,
故答案为:$\frac{{V}^{2}}{{a}^{2}}$;
③在其它条件不变的情况下,再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大,故答案为:增大;
(4)①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
点评 本题考查化学平衡计算、平衡常数、反应速率影响因素、反应热进行、电化学等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
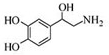
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有1个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多与2mol Br2发生取代反应 | |
| D. | 去甲肾上腺素既能与碳酸氢钠反应生成二氧化碳气体,又能与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 纯碱溶液呈碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合呈中性:2HSO4-+Ba2++2OH-═BaSO4↓+SO42-+2H2O | |
| D. | 氢氧化铜溶于氢溴酸:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 1.0 L 1.0 mol•L-1 的NaAl02水溶液中含有的氧原子数为2 NA? | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 已知C2H4和C3H6混合物的质量为ag,所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B与亚硝酸,在0~5℃反应后生成的产物与溴亚化铜和氰化钾反应生成C,C与氢氧化钠溶液共热生成2-氯-4-硝基苯酚,试推测A、B、C的构造式.
,B与亚硝酸,在0~5℃反应后生成的产物与溴亚化铜和氰化钾反应生成C,C与氢氧化钠溶液共热生成2-氯-4-硝基苯酚,试推测A、B、C的构造式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com