
向100mL 0.1mol? L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol ·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如右图所示。下列叙述正确的是
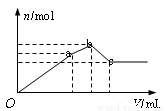
A.a点的沉淀总物质的量为0.03mol
B.oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-= 2BaSO4↓+Al(OH)3↓;
C.ab段发生反应的离子方程式是:2NH4++SO42-+Ba2++2OH-=2NH3?H2O+ BaSO4↓
D.反应到c点时,加入Ba(OH)2溶液的总体积为250mL
CD
【解析】
试题分析:硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/LBa(OH)2溶液,在O——a段发生反应:Al2(SO4)3+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓;后在a—b段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+NH3?H2O,当物质反应完全后,再加Ba(OH)2溶液的b—c段发生反应:Ba(OH)2+2Al(OH)3 =Ba(AlO2)2+ 4H2O;当Al(OH)3溶解完全,沉淀达到最小值,此后再滴加也不能产生沉淀,沉淀也不再溶解。A.n(Al3+)=0.1mol,所以a点的沉淀总物质的量为0.01mol+0.015mol=0. 025mol ,错误;B.oa段发生反应就是硫酸铝与氢氧化钡的反应,离子方程式是:2Al3++3SO42-+3Ba2++6OH-= 3BaSO4↓+ 2Al(OH)3↓,错误;C.ab段发生的是硫酸铵与氢氧化钡的反应,反应的离子方程式是:2NH4++ SO42-+ Ba2++ 2OH-=2NH3?H2O+ BaSO4↓;正确;D.反应到c点时,加入的Ba(OH)2反应变为BaSO4、 Ba(AlO2)2。由于在原溶液中含有n(SO42-)=0.02mol;n(Al3+)=0.01mol,根据元素守恒可知消耗的Ba(OH)2的物质的量是0.02mol+0.01mol÷2=0.025mol。由于Ba(OH)2溶液的物质的量浓度是0.1mol/L,所以溶液的体积是V[Ba(OH)2]0.025mol÷0.1mol/L=0.25L= 250mL,正确。
考点:考查复盐溶液中加碱,发生反应的先后、离子方程式的书写、反应图像及溶液体积的计算的知识。


科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
关于下列装置的说法正确的是
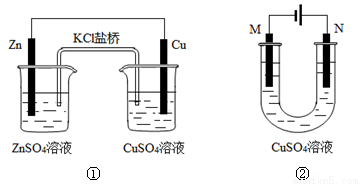
A.装置①中盐桥内的K+移向CuSO4溶液
B.装置①将电能转变为化学能
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:填空题
(14分,每空2分)四种短周期元素A、B、C、D的性质或结构信息如下。
①原子半径大小:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:

请根据上述信息回答下列问题。
(1)C元素在周期表中的位置 , 请写出D2C2分子的结构式________,A元素的单质与物质甲发生反应的离子方程式_______。
(2)丁物质与乙互为同系物,在相同条件下其蒸气的密度是氢气密度的36倍,且核磁共振氢谱只有
1组峰,写出丁物质的结构简式 。
(3)A与同周期的E元素组成的化合物EA5在热水中完全水解生成一种中强酸和一种强酸,该反应的化学方程式是 。
 (4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下)。
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:选择题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体中含相同类型的化学键
D.元素W和M的某些单质可作为水处理中的消毒剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)
铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下:

请回答下列问题:
39.沉淀B可作为化工产品出售,其用途为 ,溶液C中阴离子有 。
40.若在实验室模拟该生产,则操作IV将原料置于 中进行,确保该过程转化完全的方法是对产品(含容器)进行称量后 。
41.写出①过程中发生反应的离子方程式 ,生产过程中,NaOH、CO2、H2O和 都可循环使用。
42.有时操作Ⅱ得到的溶液为Na2CO3和NaHCO3的混合溶液。取样品溶液50.00mL加水稀释到1L,从中取出20mL。测量溶液体积的仪器事先进行洗涤的洗涤液依次为: ,对溶液体积读数的方法是读出 对应的刻度值。
43.用标准盐酸(0.2000mol/L)进行滴定:
①上述所取20.00mL溶液(酚酞做指示剂)消耗标准盐酸12.00mL。
②从1L稀释液中另取10.00mL(甲基橙做指示剂)消耗标准盐酸15.00mL。
则50.00mL原样品溶液中碳酸氢钠的浓度为 。
44.操作III进行时,为使D溶液中只有一种溶质,在每升溶液中需加入生石灰的质量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++ H2O2 +2H+→2Fe3++ 2H2O、2Fe3++ H2O2 →2Fe2++ O2↑+2H+,下列说法不正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强
B.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
C.在H2O2分解过程中,溶液的pH逐渐下降
D.H2O2生产过程要严格避免混入 Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
25℃时,0.1mol/L下列溶液的pH如下表,有关比较错误的是
序 号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中离子的总浓度:①>③
D.④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3) 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反原理为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是
A.反应中氧化剂是Na2O2,还原剂是FeSO4
B.生成2 mol Na2FeO4时,反应中共有10 mol电子转移
C.Na2FeO4的氧化性大于Na2O2
D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
下列关于铁及其化合物的说法中正确的是
A.Fe3O4是一种红棕色粉末,俗称磁性氧化铁
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.去除FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤
D.Fe3+与KSCN反应产生红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com