
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 第三周期主族元素的最高化合价等于它所在的主族序数 | |
| D. | 短周期元素形成简单离子后,最外层电子都达到8电子稳定结构 |
分析 A.位于金属与非金属交界的元素,具有金属性和非金属性;
B.非金属元素组成的化合物可能含离子键;
C.第三周期主族元素中,最高正价=族序数=最外层电子数;
D.短周期元素形成简单离子后,最外层电子达到2电子或8电子稳定结构.
解答 解:A.位于金属与非金属交界的元素,具有金属性和非金属性,如Si既有金属性,又有非金属性,故A错误;
B.非金属元素组成的化合物可能含离子键,可能只含共价键,如铵盐含离子键和共价键,故B错误;
C.第三周期主族元素中,最高正价=族序数=最外层电子数,则第三周期主族元素的最高化合价等于它所在的主族序数,故C正确;
D.短周期元素形成简单离子后,最外层电子达到2电子或8电子稳定结构,如H的阴离子为2电子结构,钠离子为最外层8电子稳定结构,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意物质中的化学键及离子结构,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏“地沟油”可以获得汽油 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 高纯度的二氧化硅广泛应用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 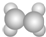 ; ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为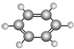 |
| C | ①由C、H、18O三种元素组成,分子中原子个数比为2:6:1;②能与Na反应,但不能 与NaOH溶液反应;③能与D反应生成相对分子质量为90的酯 |
| D | ①由C、H、O三种元素组成; ②球棍模型为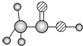 |
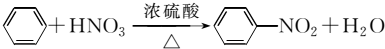
 CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
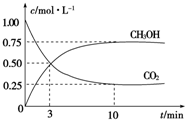 2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.
2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要是氧化还原反应原理都可以设计成原电池 | |
| B. | Cu+2H+═Cu2++H2↑在任何条件下都不能进行 | |
| C. | 金属的防护可以采取制成合金,改变内部结构的方法 | |
| D. | 现代潜艇的防腐是在潜艇底部贴锌板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 二氧化碳与足量的氢氧化钠反应:CO2+2OH-═CO32-+H2O | |
| C. | 大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com