
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
分析 该反应中Cl元素化合价由0价变为-1价、部分N元素化合价由-3价变为0价,有$\frac{1}{4}$的氨气参加氧化反应,转移电子个数为6,根据转移电子和被氧化氨的关系式计算.
解答 解:该反应中Cl元素化合价由0价变为-1价、部分N元素化合价由-3价变为0价,有$\frac{1}{4}$的氨气参加氧化反应,转移电子个数为6,即有2mol氨气参加氧化反应则有6mol电子转移,则如果有0.6mol电子 发生转移,则被氧化氨的物质的量为0.2mol,被氧化氨气的m(NH3)=0.2mol×17g/mol=3.4g,故选A.
点评 本题考查氧化还原反应的计算,侧重考查分析计算能力,明确参加氧化反应的氨气与转移电子之间的关系是解本题关键,注意并不是所有氨气都参加氧化反应,为易错点.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
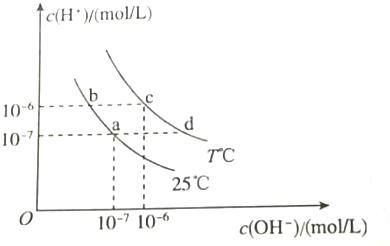
| A. | a点对应的溶液中:Al3+、Na+、Cl-、CO32- | |
| B. | b点对应的溶液中:K+、Ba2+、NO3-、AlO2- | |
| C. | c点对应的溶液中:Fe3+、Na+、I-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
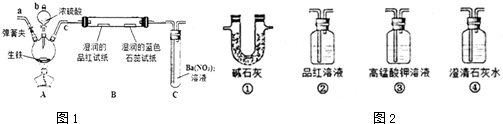
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3和BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价键的饱和性是由成键原子的未成对电子数决定的 | |
| B. | 共价键的方向性是由成键原子的轨道的方向性决定的 | |
| C. | 共价键的饱和性决定了分子内部的原子的数量关系 | |
| D. | 共价键的饱和性与原子轨道的重叠程度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使石蕊呈红色的溶液:NH4+、Ba2+、ClO-、Cl- | |
| C. | 使酚酞呈红色的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com