
| A. | 新平衡时SO2的浓度是0.1mol•L-1 | |
| B. | 新平衡时NO2的转化率为20% | |
| C. | 新、旧平衡时容器内混合气体的平均相对分子质量之比为5:3 | |
| D. | 新、旧平衡时容器内气体的压强之比是5:3 |
分析 根据反应方程式利用三段式分析
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始:1mol 2mol 0 0
转化:$\frac{2}{3}$mol $\frac{2}{3}$mol $\frac{2}{3}$mol $\frac{2}{3}$mol
平衡:$\frac{1}{3}$mol $\frac{4}{3}$mol $\frac{2}{3}$mol $\frac{2}{3}$mol
所以平衡常数K=$\frac{\frac{2}{3}×\frac{2}{3}}{\frac{1}{3}×\frac{4}{3}}$=1
增加2molNO2后
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始:1mol 4mol 0 0
转化:x x x x
平衡:1mol-x 4mol-x x x
根据K=$\frac{{x}^{2}}{(1-x)(4-x)}$=1可知,x=0.8,据此计算转化率、平衡浓度、平均相对分子质量等.
解答 解:根据反应方程式利用三段式分析
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始:1mol 2mol 0 0
转化:$\frac{2}{3}$mol $\frac{2}{3}$mol $\frac{2}{3}$mol $\frac{2}{3}$mol
平衡:$\frac{1}{3}$mol $\frac{4}{3}$mol $\frac{2}{3}$mol $\frac{2}{3}$mol
所以平衡常数K=$\frac{\frac{2}{3}×\frac{2}{3}}{\frac{1}{3}×\frac{4}{3}}$=1
增加2molNO2后
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始:1mol 4mol 0 0
转化:x x x x
平衡:1mol-x 4mol-x x x
根据K=$\frac{{x}^{2}}{(1-x)(4-x)}$=1可知,x=0.8,
A、新平衡时SO2的浓度是$\frac{1-0.8}{2}$mol•L-1=0.1mol•L-1,故A正确;
B、新平衡时NO2的转化率为$\frac{0.8}{4}$×100%=20%,故B正确;
C、该反应为气体物质的量不变的反应,所以新、旧平衡时容器内混合气体的平均相对分子质量之比为$\frac{64+4×46}{5}$:$\frac{64+92}{3}$=49.6:52,故C错误;
D、该反应为气体物质的量不变的反应,所以新、旧平衡时容器内气体的压强之比等于物质的量之比等于5:3,故D正确,
故选C.
点评 本题考查了化学计算分析应用,注意平衡常数在化学平衡计算中的应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
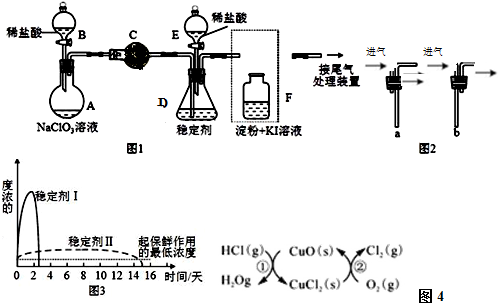
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,28 g CO、C2H4混合气体与22.4 L N2所含有的分子数都是NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
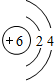 ;X元素基态原子的电子排布式为1s22s22p63s23p5.
;X元素基态原子的电子排布式为1s22s22p63s23p5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCO3在空气中灼烧 | B. | 铝条插入冷的浓硫酸中 | ||
| C. | Na2O2敞放在空气中 | D. | 向Mg(OH)2悬浊液中加入FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com