
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)先根据溶液中电荷守恒计算氢离子的浓度,然后求出pH;
(2)①二氧化硫使酸性氧化物和碱或碱性盐溶液反应;
②物质的量浓度相等的这几种溶液中,NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
(3)①依据化学反应速率和平衡移动原理分析判断;
②根据G=△H-T•△S判断反应能否自发进行.
解答 解:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性;试样的pH值根据溶液中电荷守恒:c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)计算H+离子浓度为10-4,该样本的pH=4,
故答案为:4;
(2)洗涤含SO2的烟气,根据酸性氧化物的性质可选a.氨水 b.Na2CO3,而氯化钙和亚硫酸氢钠不与二氧化硫反应,碳酸钠碱性较弱,最好选用氨水,
故答案为:a;
②(NH4)2Fe(SO4)2、(NH4)2SO3中铵根离子系数是2,NH4HSO4中铵根离子系数都是1,所以(NH4)2Fe(SO4)2、(NH4)2SO3比NH4HSO4的大,(NH4)2Fe(SO4)2中二价铁离子抑制铵根离子水解,浓度最大,
故答案为:(NH4)2Fe(SO4)2;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:吸热反应,温度升高,平衡正向移动,NO的含量增大;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,
故答案为:否,因△H>0且△S<0,则在任何温度下△G>0,不可能自发进行.
点评 该题考查较为综合,涉及离子的水解、pH值的计算、化学平衡常数的计算、自由能的应用等知识,题目难度中等,明确反应能够自发进行的条件为解答关键,注意掌握溶液酸碱性与溶液pH的关系.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 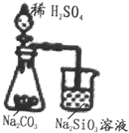 可以用业证明非金属性的相对强弱S>C>Si 可以用业证明非金属性的相对强弱S>C>Si | |
| B. | 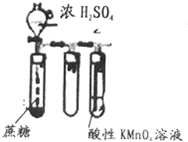 可以用来检验是否有还原性气体生成 可以用来检验是否有还原性气体生成 | |
| C. | 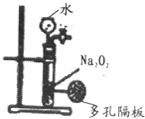 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 | |
| D. |  滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气为体积比为1:2的乙烯和乙炔 | |
| B. | 原混合气为体积比为1:1的丙烯和丙炔 | |
| C. | 原混合气为任意体积比的乙烯和乙炔 | |
| D. | 原混合气为体积比为1:2的乙烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:| 化学键 | O-H | N-N | N-H | O=O | N═N |
| 键能/KJ•mol-1 | 467 | 160 | 391 | 498 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
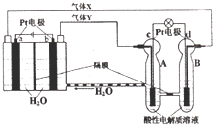
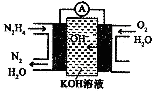
| A. | 有0.1mol电子转移时,a电极产生1.12LO2 | |
| B. | c极上发生还原反应,B中的H+可以通过隔膜进入A | |
| C. | b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯环上的一氯代物种数相同 | |
| B. | 分子中共面的碳原子数一定相同 | |
| C. | 1 mol甲与浓溴水反应最多能消耗4 mol Br2 | |
| D. | 甲、乙可用红外光谱区分,但不能用核磁共振氢谱区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )| A. | Li 发生氧化反应,a 极为阴极 | |
| B. | 电子由 a 极流出通过电流表流入 b 极,然后再由 b 极经内电路回到 a 极 | |
| C. | 可以用水代替 SO(CH3)2做溶剂 | |
| D. | b 极反应式是 FeS2+4Li++4e-═Fe+2Li2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol•L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol•L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com