
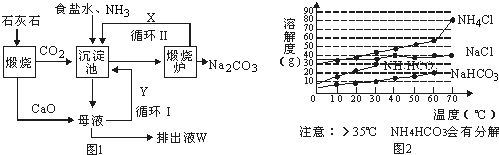
分析 侯氏制碱法制取纯碱反应原理可用下列化学方程式表示:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O根据反应原理,饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,再加热碳酸氢钠晶体就可以得到纯碱.
(1)根据碳酸氢钠煅烧的产物考虑;
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,;
(3)根据题中所给信息“35℃NH4HCO3会有分解”分析解答,根据影响反应速率的因素分析,要控制恒温;
(4)母液中含有氯化铵,加入石灰乳后可以生成氨气;
(5)电解饱和氯化钠溶液,能生成氢氧化钠、氯气和氢气;
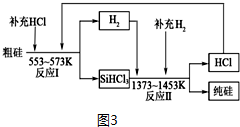
①写出反应物和给出的生成物H2SiO3和HCl,用原子守恒法找出另一种生成物为H2,并配平;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1.
解答 解:(1)碳酸氢钠煅烧生成碳酸钠、水、二氧化碳,所以X是二氧化碳(CO2),故答案为:CO2;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,否则不能析出NaHCO3晶体,故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3,不能析出NaHCO3晶体;
(3)根据题意“35℃NH4HCO3会有分解”,所以温度不能超过35℃;同时反应速度受温度影响,温度太低反应速率太慢,所以温度必须控制在一个合理范围内,使温度保持一个恒定,故答案为:NaHCO3溶解度小,低于300C反应速率慢,高于350C NaHCO3分解,不利于NaHCO3晶体析出;
(4)过滤后得到的母液中含有氯化铵,母液中加入石灰乳后,反应生成氨气,方程式为:CaO+2NH4Cl=CaCl2+2NH3↑+H2O,故答案为:CaO+2NH4Cl=CaCl2+2NH3↑+H2O;
(5)电解饱和氯化钠溶液的方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,碱是指NaOH,故答案为:NaOH;
①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,故答案为:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1,补充HCl与H2的物质的量之比为≈5:1,故答案为:5:1.
点评 本题主要考查了学生运用溶解度有关知识分析解决纯碱制取过程中有关问题.联合制碱法的原料、反应式以及副产物的回收利用,还考查硅及其化合物的性质,涉及化学方程式的书写、以及根据方程式的计算,计算是该题的难点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶液具有酸性,可用于清除铜镜表面的铜锈 | |
| B. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| C. | 氨气能使酚酞试液变红,可用于设计喷泉实验 | |
| D. | 氧化铁能与酸反应,可用于制作红色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
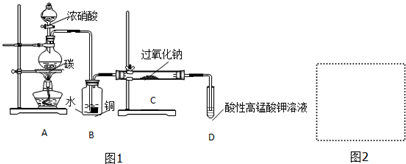

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com