
| A. | LiH跟水反应后的溶液显中性 | B. | LiH在化学反应中是一种强氧化剂 | ||
| C. | LiH中氢离子可以被还原成氢气 | D. | LiH中氢离子半径比锂离子半径大 |
分析 在离子化合物LiH中,Li+与H-以离子键结合而成,该物质溶于水生成H2,可以想到H-与水中的H+之间发生氧化还原反应,除生成H2外,另一产物应是LiOH,所以对该反应的分析可根据下列几点:①属于氧化还原反应;②LiH是还原剂,H2O是氧化剂;③所得溶液是LiOH碱性溶液.
解答 解:A、LiH跟水反应的方程式为LiH+H2O=H2↑+LiOH,溶液呈碱性,故A错误;
B、LiH+H2O=H2↑+LiOH反应中,LiH是还原剂,H2O是氧化剂,故B错误;
C、在离子化合物LiH中,Li+与H-以离子键结合而成,H-与水中的H+之间发生氧化还原反应而被氧化,故C错误;
D、LiH中氢离子与锂离子核外电子排布相同,核电核数越小,半径越大,则LiH中氢离子比锂离子的半径大,故D正确.
故选:D.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价的角度分析物质的性质.


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
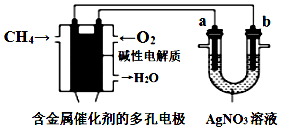
| A. | 电子经导线流入b电极 | |
| B. | 若b极增重5.4 g时,燃料电池负极消耗CH4的体积为140 mL | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O═4OH- | |
| D. | 此装置用于电镀银时,一段时间后硝酸银溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
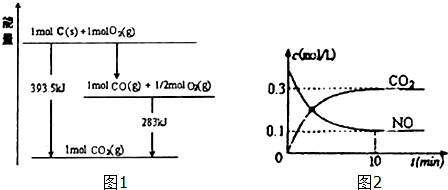
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 实验②中,混合物过量 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
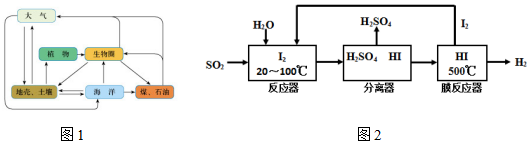

压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
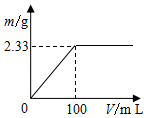 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
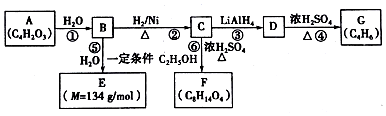
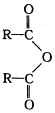 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)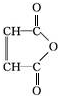 .
.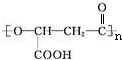 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
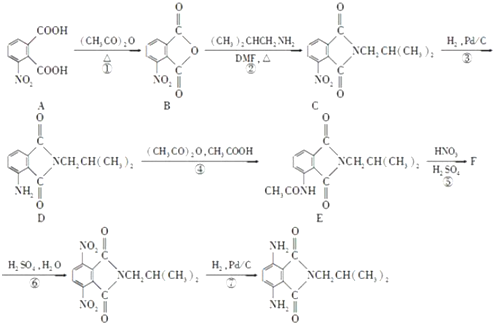
 )有还原性,易被氧化;
)有还原性,易被氧化;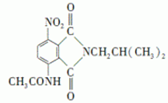 .
.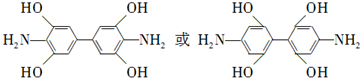 .
.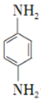 是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com