
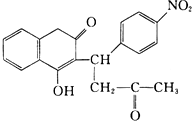
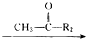 R1-CH�T
R1-CH�T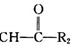 +H2O
+H2O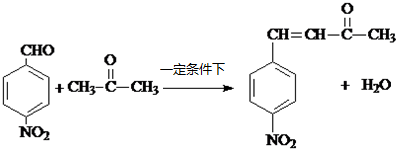 ��
�� ��
��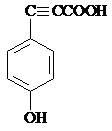 ��
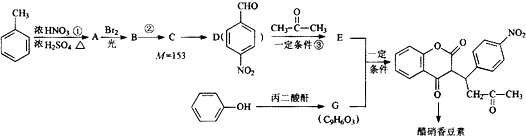
�� ���� �ױ������ᷢ��ȡ����Ӧ����A������D�Ľṹ֪��A�ṹ��ʽΪ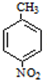 ��B�Ľṹ��ʽΪ
��B�Ľṹ��ʽΪ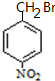 �����C��Է�������֪��C�ṹ��ʽΪ
�����C��Է�������֪��C�ṹ��ʽΪ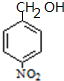 ��D�ͱ�ͪ��Ӧ����E��E�ṹ��ʽΪ
��D�ͱ�ͪ��Ӧ����E��E�ṹ��ʽΪ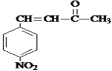 �����Ӻͱ���������Ӧ����G��E��G��Ӧ���ɴ����㶹�أ����ݴ����㶹�ؽṹ��ʽ֪��G�ṹ��ʽΪ
�����Ӻͱ���������Ӧ����G��E��G��Ӧ���ɴ����㶹�أ����ݴ����㶹�ؽṹ��ʽ֪��G�ṹ��ʽΪ ���ݴ˷������
���ݴ˷������
��� �⣺�ױ������ᷢ��ȡ����Ӧ����A������D�Ľṹ֪��A�ṹ��ʽΪ ��B�Ľṹ��ʽΪ
��B�Ľṹ��ʽΪ �����C��Է�������֪��C�ṹ��ʽΪ
�����C��Է�������֪��C�ṹ��ʽΪ ��D�ͱ�ͪ��Ӧ����E��E�ṹ��ʽΪ
��D�ͱ�ͪ��Ӧ����E��E�ṹ��ʽΪ �����Ӻͱ���������Ӧ����G��E��G��Ӧ���ɴ����㶹�أ����ݴ����㶹�ؽṹ��ʽ֪��G�ṹ��ʽΪ
�����Ӻͱ���������Ӧ����G��E��G��Ӧ���ɴ����㶹�أ����ݴ����㶹�ؽṹ��ʽ֪��G�ṹ��ʽΪ ��
��
��1��ͨ�����Ϸ���֪����Ӧ�ٵķ�Ӧ������ȡ����Ӧ����������Ӧ����
�ʴ�Ϊ��ȡ����Ӧ����������Ӧ����
��2����A��B����Ĺ�������������ԭ�ӣ��ʴ�Ϊ����ԭ�ӣ�
��3����Ӧ�ڵĻ�ѧ����ʽΪ��
�ʴ�Ϊ����
��4����Ӧ�۵Ļ�ѧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��5��EΪ ��
��
a���ں˴Ź������������������շ壬�ʴ���
b��E�к���̼̼˫�����ʻ���������D�к���ȩ����������̼̼˫����ȩ�����ܱ����Ը��������Һ���������Բ����������Ը��������Һ����D��E���ʴ���
c��E�к���̼̼˫�����ʻ������������������Է����ӳɷ�Ӧ���ۺϷ�Ӧ��������Ӧ�ͻ�ԭ��Ӧ������ȷ��
d��̼̼˫��̼ԭ�����Ӳ�ͬ��֧�������Դ���˳���칹������ȷ��
��ѡcd��
��6��G�ṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��7��GΪ �����ӽṹ��ֻ����һ������G��ͬ���칹���������������
�����ӽṹ��ֻ����һ������G��ͬ���칹���������������
?�ٿ����Ȼ�����Һ������ɫ��Ӧ��˵�����з��ǻ���
?�ڿ���̼��������Һ��Ӧ���ɶ�����̼���壬˵�������Ȼ���
���ȡ����Ϊ-COOH��-C��CH��-OH��
���-COOH��-OHλ����λ����4��ͬ���칹�壻
���-COOH��-OHλ�ڼ�λ����4��ͬ���칹�壻
���-COOH��-OHλ�ڶ�λ����2��ͬ���칹�壻
���ȡ����Ϊ-C��CCOOH��-OH�����ڼ�����ֽṹ��
������13��ͬ���칹�壻
�ұ����ϵ�һ�ȴ���ֻ�����ֵ�ͬ���칹��Ľṹ��ʽΪ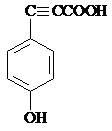
�ʴ�Ϊ��13��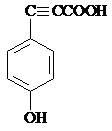
���� ���⿼���л����ƶϣ�Ϊ�߿���Ƶ�㣬���ؿ���ѧ�������ƶ��������Լױ��Ͷ������ױ��ṹ��ʽ��Ϸ�Ӧ���������ƶ����ʣ�ע���������Ϣ����ȷD����Eʱ�ϼ��ͳɼ���ʽ���ѵ���ͬ���칹��������жϣ�ע��̼̼˫��̼ԭ���ϲ�������-OH��Ϊ�״��㣮


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Y����������ܺ�ˮ��Ӧ | |
| B�� | X��Y�γɵĻ�������������ӻ����Ҳ�����ǹ��ۻ����� | |
| C�� | X��ԭ�Ӱ뾶һ������Y��ԭ�Ӱ뾶 | |
| D�� | X��Y�ļ����Ӳ����ܾ�����ͬ�ĵ��Ӳ�ṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ϊ��ֹ�����⣬�������Ϳһ��������� | |
| B�� | Ϊ��ֹ���֣�����۳�������վ�ȳ���Ҫ�Ͻ��̻� | |
| C�� | Ϊ�ӿ�H2O2�ķֽ����ʣ��ѷ�Ӧ�����ŵ���ˮ����ȴ | |
| D�� | Ϊ�ӿ�KClO3�ķֽ����ʣ�����MnO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.10mol•L-1NH4HCO3��Һ��ͨ��CO2��c��NH4+��=c��HCO3-��+c��CO32-�� | |
| B�� | 0.10mol•L-1CH3COONa��Һ��ͨ��HCl��c��Na+����c��Cl-����c��CH3COOH�� | |
| C�� | 0.10mol•L-1Na2SO3��Һͨ��SO2��c��Na+��=2[c��SO32-��+c��HSO3-��+c��H2SO3��] | |
| D�� | ��0.10mol•L-1NaHSO3��Һ��ͨ��NH3��c��Na+����c��SO32-����c��NH4+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
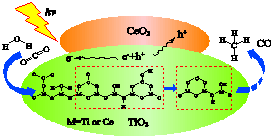 2016��3���½����������о������ȷ��֣��ڹ⡢����CeO2����TiO2�ĸ������ײ��ϵĴ������£�������̼��ˮ��ת��Ϊ�����һ����̼������˵������ȷ���ǣ�������
2016��3���½����������о������ȷ��֣��ڹ⡢����CeO2����TiO2�ĸ������ײ��ϵĴ������£�������̼��ˮ��ת��Ϊ�����һ����̼������˵������ȷ���ǣ�������| A�� | �˷�Ӧ�ɽ�����ת��Ϊ��ѧ�� | |
| B�� | CO2��CH4�������Թ��ۼ� | |
| C�� | ������ܻ���O2 | |
| D�� | CO2����ˮ�����Ե�ԭ��CO2+H2O?H2CO3H2CO3?2H++CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
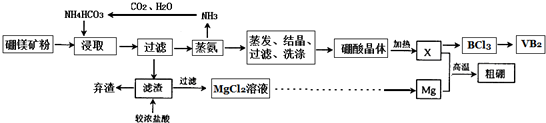
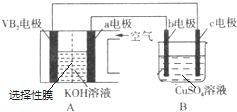
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ȱ�������һ��ҩ���м��壬���ö��ȼױ�Ϊԭ�ϣ�ͨ����������������Ʊ�����Ӧ���£�
���ȱ�������һ��ҩ���м��壬���ö��ȼױ�Ϊԭ�ϣ�ͨ����������������Ʊ�����Ӧ���£�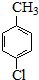 $��_{����}^{KMnO_{4}}$
$��_{����}^{KMnO_{4}}$
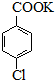 $\stackrel{H+}{��}$
$\stackrel{H+}{��}$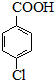
| �۵�/�� | �е�/�� | �ܶ�/g•cm��3 | ��ɫ | ˮ���� | |
| ���ȼױ� | 7.5 | 162 | 1.07 | ��ɫ | ���� |
| ���ȱ����� | 243 | 275 | 1.54 | ��ɫ | �� |
| ���ȱ������ | �����ε�ͨ�ԣ����ڿ������Σ��ܽ�����¶����߶����� | ||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | 1 | 2 | 3 | 4 |
| ������mL�� | 19.22 | 19.18 | 19.80 | 19.20 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com