
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
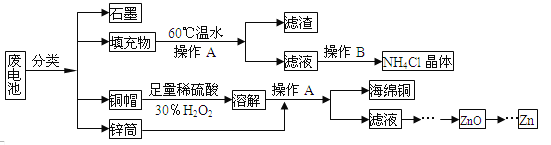
(1)填充物用60℃温水溶解,目的是__________。
(2)操作A的名称为____________。
(3)铜帽溶解时加入H2O2的目的是_______________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为___________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有_____mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:_____________。
【答案】加快溶解速率 过滤 Cu+H2O2+H2SO4=CuSO4+2H2O 加热 Zn+2OH--2e-=Zn(OH)2 4 2MnO(OH)+6HCl(浓)![]() 2MnCl2+Cl2↑+4H2O
2MnCl2+Cl2↑+4H2O
【解析】
(1)由于物质的溶解速率随温度的升高而增大。所以填充物用60 ℃温水溶解,目的是加快溶解速率;
(2)分离难溶性固体与液体混合物的操作名称为过滤;
(3)H2O2具有强氧化性,Cu与稀硫酸不反应,但在酸性条件下,加入H2O2的Cu就会被溶解变为Cu2+,反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O;H2O2不稳定,受热容易分解产生氧气和水,所以铜帽溶解完全后,可采用加热方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=" 2MnOOH" +Zn(OH)2,负极Zn发生氧化反应,电极反应式为Zn+2OH--2e-=Zn(OH)2。
(5) ①根据方程式2MnO(OH)+MnO2+2H2C2O4 +3H2SO4=2MnSO4+4CO2↑+6H2O转移4e-,可知:当1 mol MnO2参加反应时,共有4 mol的电子发生转移;
②MnO(OH)与浓盐酸在加热条件下也可发生反应,则该反应的化学方程式是:
2MnO(OH)+6HCl(浓)![]() 2MnCl2+Cl2↑+4H2O。
2MnCl2+Cl2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):

已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种白色晶体,有与石墨相似的层状结构,层内的H3BO3分子通过氢键相连(如图所示)。H3BO3在冷水中溶解度较小,可溶于热水,在水中的解离反应为:H3BO3+H2O![]() H++B(OH)4-。下列有关说法中正确的是( )
H++B(OH)4-。下列有关说法中正确的是( )

A.正硼酸晶体属于原子晶体
B.H3BO3和B(OH)4-中B原子杂化轨道的类型都为sp2
C.H3BO3是三元弱酸
D.含1molH3BO3的晶体中含有3mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与![]() 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
A.混合物X中必定含有![]() ,不含
,不含![]()
B.溶液Z中溶质主要是钠盐,且必含![]()
C.灼烧沉淀Y,可能得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的化工原料,可发生如下转化。下列说法中不正确的是( )
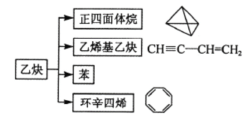
A.以上转化均为加成反应
B.正四面体烷的二氯代物只有1种结构
C.苯乙烯(![]() )和环辛四烯互为同分异构体
)和环辛四烯互为同分异构体
D.等质量的苯和乙烯基乙炔充分燃烧时消耗氧气的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
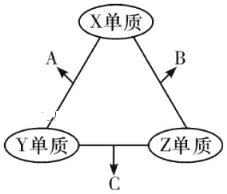
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com