
| A. | 碘升华 | B. | 盐酸和氢氧化钠溶液混合 | ||
| C. | 氯化氢溶于水 | D. | 氯化氢与氨气反应生成氯化铵固体 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A(g)+B(g)→C(g)+D(l)是放热反应 | |
| B. | A(g)+B(g)→C(g)+D(l)是吸热反应 | |
| C. | C(g)+D(l)→A(g)+B(g)是放热反应 | |
| D. | C(g)+D(l)具有的能量大于A(g)+B(g)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,一定有一种元素被氧化,另一种元素被还原 | |
| B. | 物质所含元素的化合价越高,该物质的氧化性就越强 | |
| C. | HClO既有氧化性,又有还原性 | |
| D. | 1molCl2参加反应转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn|H2SO4(稀)|C | B. | Cu|AgNO3(aq)|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
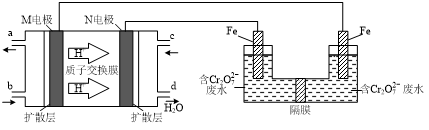
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr $\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr | |
| C. | 苯酚钠溶液中通入少量二氧化碳: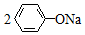 +CO2→ +CO2→ +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硝酸}$C6H12O6(葡萄糖)+C6H12O6(果糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4═Na++SO42- | B. | Ba(OH)2═Ba2++(OH)22- | ||
| C. | CH3COOH═CH3COO-+H+ | D. | NH4Cl═NH4++Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com