
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.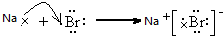 .
. 分析 根据元素在周期表中的位置知,①~⑨分别是Na、K、Mg、Al、C、O、Cl、Br、Ar元素,
(1)同一周期元素,金属性随着原子序数增大而减弱,非金属性随着原子序数增大而增强,同一主族元素,金属性随着原子序数增大而增强、非金属性随着原子序数增大而减弱;稀有气体最不活泼;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素的金属性越强,其最高价氧化物是水化物碱性越强,氢氧化铝呈两性;
(3)原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(4)⑥的氢化物是水,水和K反应生成KOH和氢气,溶液呈碱性;
(5)①和⑧元素生成离子化合物溴化钠.
解答 根据元素在周期表中的位置知,①~⑨分别是Na、K、Mg、Al、C、O、Cl、Br、Ar元素,
(1)同一周期元素,金属性随着原子序数增大而减弱,非金属性随着原子序数增大而增强,同一主族元素,金属性随着原子序数增大而增强、非金属性随着原子序数增大而减弱,这些元素中金属性最强的是K元素、非金属性最强的是O元素;稀有气体Ar最不活泼,
故答案为:K;O;Ar;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,这几种元素中酸性最强的是HClO4,元素的金属性越强,其最高价氧化物是水化物碱性越强,碱性最强的是KOH,电子式为 ,氢氧化铝呈两性,所以能形成两性氢氧化物的元素是Al,
,氢氧化铝呈两性,所以能形成两性氢氧化物的元素是Al,
故答案为:HClO4; ;Al;
;Al;
(3)原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是K>Na>Mg,故答案为:K>Na>Mg;
(4)⑥的氢化物是H2O,水和K反应生成KOH和氢气,反应方程式为2 K+2 H2O=2KOH+H2↑,溶液呈碱性,溶液的pH>7,
故答案为:H2O;2 K+2 H2O=2KOH+H2↑;>;
(5)①和⑧元素生成离子化合物溴化钠,其形成过程为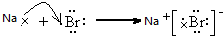 ,故答案为:
,故答案为: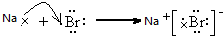 .
.
点评 本题考查元素周期表和元素周期律,涉及物质结构、物质性质及元素周期律,明确同一周期、同一主族元素性质递变规律是解本题关键,知道非金属性强弱、金属性强弱判断方法,难点是用电子式表示化合物形成过程.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 ]-.
]-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 位于周期表中第三周期第ⅢA族的元素 | |
| C. | 基态原子最外电子层排布为2s22p6的元素 | |
| D. | 基态原子最外电子层排布为3s23p5的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极增重1.4g | B. | 所得溶液pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业合成氨是利用氮气和氢气在一定条件下反应生成的.氨是重要的工业原料.请回答下列问题:
工业合成氨是利用氮气和氢气在一定条件下反应生成的.氨是重要的工业原料.请回答下列问题: ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com