
【题目】如图所示:在B水槽中装有500 mL水,容积为VL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充 分反应后,试管A中余下气体的体积为0.6VL。

(1)将A倒插入B槽中发生的反应的化学方程为_________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质 的量之比为________。
(2)通过导气管C向余下0.6VL气体的试管A中持续通入氧气,A中可能观察到的现象是_________________________________
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L-1(设溶液的体积仍为500 mL)。
【答案】 3NO2+H2O===2HNO3+NO 1∶2 3∶2 无色气体变为红棕色,试管中液面不断上升至全充满。继续通入氧气后,试管中液面下降,最后充满无色气体 V/11.2
【解析】(1)将A倒插入B水槽中,二氧化氮与水反应生成硝酸和一氧化氮气体,反应的化学方程式为:![]() ,该反应中,二氧化氮中+4价N元素被氧化成+5价的硝酸,同时被还原成+2价的一氧化氮,则3mol二氧化氮参与反应,作氧化剂被还原的二氧化氮为1mol,作还原剂被氧化的有2mol,则氧化剂与还原剂的质量之比为1:2;
,该反应中,二氧化氮中+4价N元素被氧化成+5价的硝酸,同时被还原成+2价的一氧化氮,则3mol二氧化氮参与反应,作氧化剂被还原的二氧化氮为1mol,作还原剂被氧化的有2mol,则氧化剂与还原剂的质量之比为1:2;
充满了NO2和NO的混合气体(标准状况)试管A倒水中.充分反应后,试管A中余下气体的体积为0.6vmL,则:设NO为y,NO2为X
![]()
31
X 1/3X
Y+1/3X=0.6V X+Y=V 解X=0.6V Y=0.4V![]() =0.6V:0.4V=3:2
=0.6V:0.4V=3:2
因此,本题正确答案是:![]() ;1:2 3:2;
;1:2 3:2;
(2)剩余NO,持续通入氧气,会发生![]() ,无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体,因此,本题正确答案是:无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;
,无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体,因此,本题正确答案是:无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;
(3)根据氮元素守恒可以知道,水槽中生成硝酸的物质的量为:
![]() =V/22.4,故硝酸的浓度为c(HNO3)=V/22.4
=V/22.4,故硝酸的浓度为c(HNO3)=V/22.4![]() 0.5=V/11.2mol/L.。答案:V/11.2。
0.5=V/11.2mol/L.。答案:V/11.2。
点睛:(1)将A倒插入B水槽中发生反应![]() ,根据化合价变化判断氧化剂、还原剂及其质量之比;根据气体体积减小量,利用差量法计算二氧化氮的体积,进而计算NO的体积,体积之比等于物质的量之比;
,根据化合价变化判断氧化剂、还原剂及其质量之比;根据气体体积减小量,利用差量法计算二氧化氮的体积,进而计算NO的体积,体积之比等于物质的量之比;
(2)剩余NO,持续通入氧气,会发生,![]() 无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;(3)根据氮元素守恒,氮元素守恒可以知道
无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体;(3)根据氮元素守恒,氮元素守恒可以知道![]() ,再根据
,再根据![]() 计算所得硝酸的浓度.
计算所得硝酸的浓度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在无色溶液中能大量共存的离子组是
A. HCO3-、Na+、OH-、K+ B. CH3COO-、Ba2+、MnO4-、H+
C. NO3-、H+、Cl-、Cu2+ D. SO42-、K+、Cl-、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.4 mol·L-1。向该混合溶液中加入1.92 g铜粉,加热,待充分反应后(假设反应前 后溶液体积不变),所得溶液中Cu2+的物质的量浓度是( )
A. 0.15 mol·L-1 B. 0.225 mol·L-1
C. 0.30 mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在密闭容器中反应A(g)+3B(g)2C(g) 在一定温度下达到平衡,
(1)在平衡时测得各物质的物质的量分别为n(A)=1.0mol、n(B)=0.4mol、n(C)=0.4mol,此时容器体积为2L,则此条件下的平衡常数K= .
(2)若保持温度和压强不变,在(1)中平衡中向上述容器中通入0.36mol A (g),平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的说法中正确的是
A. 分液时,下层液体从下口放出,上层液体从上口倒出
B. 蒸发时,应使混合物中的水分完全蒸干后,再停止加热
C. 蒸馏时,温度计的水银球插入液面以下
D. 用100mL量简量取8.5mL浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( ) 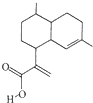
A.分子式为C15H24O2
B.属子芳香族化合物
C.能发生取代反应和加成反应
D.分子中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________(填名称),可以验证该结论的实验是_______。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________(用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com