
分析 溶液无色,一定没有高锰酸根离子,
①能够与盐酸生成气体的离子为碳酸根离子,能够与碳酸根离子反应的离子不能存在;
②说明发生了双水解,一定存在与碳酸氢根离子发生双水解的离子;
③气体乙为氨气,白色沉淀为碳酸钡或硫酸钡,据此进行推断.
解答 解:某无色溶液,说明溶液中一定不会存在高锰酸根离子,
①加入过量盐酸,有气体生成,并得到无色溶液,生成的气体甲为二氧化碳,所以溶液中一定存在CO32-,一定不存在SO32-、Ag+、Ba2+、Al3+,阳离子只剩下了钠离子,根据溶液一定呈电中性可知溶液中一定存在Na+;
②在A所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲,白色沉淀甲为氢氧化铝,原溶液中一定存在AlO2-,
③在B所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀乙,白色沉淀一定含有碳酸钡,可能含有硫酸钡;
(1)由以上分析可知溶液中一定存在的离子有:CO32-、Na+、AlO2-,故答案为:CO32-、Na+、AlO2-;
(2)由以上分析可知溶液中一定不存在MnO4-、Ag+、Ba2+、Al3+,
故答案为:MnO4-、Ag+、Ba2+、Al3+;
(3)白色沉淀甲为氢氧化铝,属于两性氢氧化物,既能和强酸反应又能和强碱反应,即Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═-+2H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O;
(4)白色沉淀乙一定含有碳酸钡,可能含有硫酸钡,可加入盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,
故答案为:取少量沉淀乙置于试管中,加入足量盐酸,若沉淀全部溶解,则沉淀乙为BaCO3;若沉淀不完全溶解,则沉淀乙为BaCO3和BaSO4.
点评 本题考查了常见离子的检验方法,题目难度不大,注意根据溶液呈电中性判断溶液中存在的离子方法,本题充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法.


科目:高中化学 来源: 题型:选择题
| A. | 2mol/L NaOH溶液 | B. | 2mol/LH2SO4溶液 | C. | 2mol/LMgSO4溶液 | D. | FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
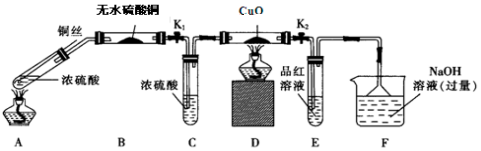
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造普通玻璃的主要原料是纯碱、石灰石和石英 | |
| B. | 盛放烧碱溶液的试剂瓶不能用玻璃塞 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
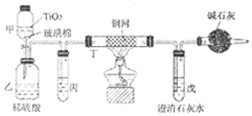
 .
.| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a电极是该电池的负极,发生氧化反应 | |
| B. | b电极反应式为2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | 电池工作时,H+由左室通过质子交换膜进入右室 | |
| D. | 转化室中发生反应后溶液的pH增大(忽略体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
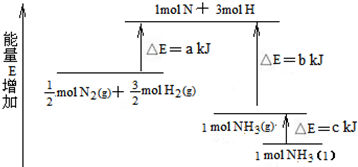
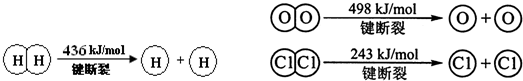
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$
一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com