
| A. | 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3 | |
| B. | 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42- | |
| C. | 向SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 | |
| D. | 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |
分析 A.发生强酸制取弱酸的反应;
B.白色沉淀为硫酸钡;
C.淡黄色沉淀产为S,由S元素的化合价变化判断;
D.溶液颜色褪去,Mn元素的化合价降低,S元素的化合价升高.
解答 解:A.向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,气体为二氧化碳,发生强酸制取弱酸的反应原理,则说明H2SO3酸性强于H2CO3,故A正确;
B.向SO2水溶液中滴加Ba(NO3)2溶液,发生氧化还原反应生成硫酸钡白色沉淀,但SO2水溶液中不含有SO42-,故B错误;
C.将SO2水溶液中通入H2S气体,发生氧化还原反应生成淡黄色沉淀S,由S元素的化合价降低可知SO2水溶液具有氧化性,故C正确;
D.向KMnO4溶液中滴加SO2水溶液,发生氧化还原反应溶液颜色褪去,由S元素的化合价升高可知SO2水溶液具有还原性,故D错误;
故选AC.
点评 本题考查二氧化硫的性质,为高频考点,把握二氧化硫的氧化性、还原性、漂白性为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 等于0.9mol | B. | 等于0.45mol | ||
| C. | 大于0.45mol,小于0.9mol | D. | 小于0.45mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 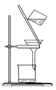 装置可用于提纯胶体 | |
| B. | 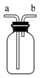 装置可用于排空气法收集气体,可收集CO2、NH3、H2等 | |
| C. |  装置可用于吸收SO2 | |
| D. |  装置可用验证浓硫酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | Ag2CO3白色悬浊液中滴加少量Na2S溶液,出现黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
| B | 向某溶液中加入氯化钡溶液,产生白色沉淀,再加入过量的稀盐酸,沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | CO32-结合质子的能力比C6H5O-强 |
| D | 向溶液X中加入Na2O2粉末,出现红褐色沉淀和无色气泡 | X中一定含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeC13溶液中:A13+、NH4+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、K+、SO42-、NO3- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-15mol/L的溶液中:Na+、Fe3+、I-、AlO2- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是比胶体更稳定的分散系 | |
| B. | 相同状況下,1L空气与1LO2所含的分子数相等 | |
| C. | 相同状况下,1 L空气与1 L薄雾所含的分子数相等 | |
| D. | 20mL0.2 mol•L-1NaCl 溶液和 50mL0.1 mol•L-1 MgCl2 溶液中的 c((Cl- )相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是一样的 | |
| C. | MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.
物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol•L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol•L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
| A. | 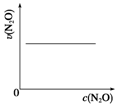 | B. |  | C. | 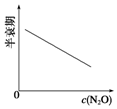 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com