
【题目】(1)某有机物分子式为C2H6O,该化合物的核磁共振氢图如图所示,请写出其结构简式___。
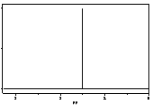
(2)有机物CH3-CH2-CH2-OH(1-丙醇),核磁共振氢谱共有___个特征峰,峰强度比为___。
(3)苯的同系物C9H12的核磁共振氢谱图,有2个特征峰,且峰面积之比为1:3,其结构简式___。
(4)已知:1,3-丁二烯的一类二烯烃能发生与具有双键的化合物进行1,4-加成反应,生成环状化合物,这类反应称为双烯合成,例如:

在下列横线上写出适当的反应物或生成物的结构简式,完成下列反应的化学方程式:
①![]() +
+![]() →___
→___
②___+___→![]()
【答案】CH3OCH3 4 3:2:2:1 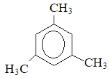
![]()
![]()
![]()
【解析】
(1)核磁共振氢谱中吸收峰的个数等于有机物中氢原子的种类数,核磁共振氢谱中只给出一种峰,说明该分子中的H原子都是等效的,只有1种H原子;
(2)分子中有几种等效氢原子就有几种峰,峰面积之比等于氢原子个数之比;
(3)核磁共振氢谱只有两个吸收峰说明有2类氢原子;
(4)根据1,3-丁二烯与乙烯反应![]() 知,1,3-丁二烯中的两个碳碳双键断裂中间形成一个碳碳双键,边上两个半键与乙烯中的两个半键相连构成环状,类比1,3-丁二烯与乙烯的加成反应分析。
知,1,3-丁二烯中的两个碳碳双键断裂中间形成一个碳碳双键,边上两个半键与乙烯中的两个半键相连构成环状,类比1,3-丁二烯与乙烯的加成反应分析。
(1)由图可知,该有机物的核磁共振氢谱图中只有一种吸收峰,则6个H原子都是等效的,CH3OCH3中2个甲基连在同一个碳原子上,6个H原子都是等效的,则该有机物的结构简式为CH3OCH3;
故答案为:CH3OCH3;
(2)有机物CH3-CH2-CH2-OH(1-丙醇)中,甲基上3个氢原子相同,两个-CH2-的氢原子不同,羟基上的氢原子,共4种氢原子,个数之比为3:2:2:1;,则核磁共振氢谱共有4个特征峰,峰面积之比为3:2:2:1;
故答案为:4;3:2:2:1;
(3)苯的同系物C9H12的核磁共振氢谱图,有2个特征峰,且峰面积之比为1:3,说明有2类氢原子,且个数比为1:3,则该分子的结构简式为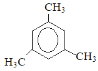 ;
;
故答案为: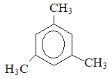 ;
;
(4)①2丁烯![]() 和1,3丁二烯
和1,3丁二烯![]() 反应,1,3丁二烯的两个碳碳双键断裂,中间两个半键形成碳碳双键,边上两个半键与2丁烯双键断裂形成的两个半键相连接形成环状,所以生成物的是
反应,1,3丁二烯的两个碳碳双键断裂,中间两个半键形成碳碳双键,边上两个半键与2丁烯双键断裂形成的两个半键相连接形成环状,所以生成物的是![]() ;
;
故答案为:![]() ;
;
②由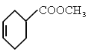 知反应物中一种物质含有两个双键,且在单键的两侧,即一种反应物为
知反应物中一种物质含有两个双键,且在单键的两侧,即一种反应物为![]() ,另外一种反应物断键以后和1,3丁二烯发生1,4加成反应,形成新的双键,故未断键前另一种反应物为
,另外一种反应物断键以后和1,3丁二烯发生1,4加成反应,形成新的双键,故未断键前另一种反应物为![]() ,反应方程式为:
,反应方程式为:![]() +
+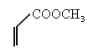
![]()
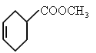 ;
;
故答案为:;
![]() 。
。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)=Y(s)+2Z(g) ΔH>0,反应达到最大限度前,测得X的浓度与反应时间的数据如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/mol·L-1 | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
试回答下列问题:
(1)0~3min内,用Z表示的平均反应速率v(Z)=___。
(2)分析该反应中反应物的浓度随时间的变化规律,得出的结论是___。由此结论推出a为___。
(3)该反应的逆反应速率随时间变化的关系如图所示,t2时改变了某一反应条件,则改变的条件为___。
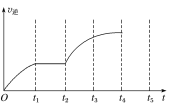
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向体积恒定的密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A.容器内压强不随时间变化
B.v正(X)=2v逆(Y)
C.容器内X、Y、Z的浓度之比为1︰2︰2
D.单位时间消耗0.1mol X同时生成0.2mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20mL0.1mol/L HR 溶液中滴加0.1000mol/LNaOH溶液,混合溶液的PH与所加NaOH溶液体积的关系如图所示。下列推断正确的是
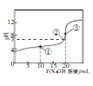
A. ①、②、③三点中,③对应的溶液中c水(H+)·c水(OH-)最大
B. HR溶液中只存在H+、R-、OH-、H2O四种微粒
C. ②点溶液中一定存在c(Na+)>c(R-)>c(H+)=c(OH-)
D. NaR的水解常数Ka和水解程度:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:图甲是由某温度下![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
图甲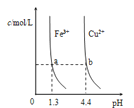 图乙
图乙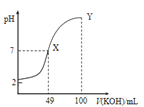
A.由图甲知:![]()
B.由图甲知:a、b点溶液中![]() ,b点的大
,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测得某温度下0.5mol·L-1 HNO2(亚硝酸)溶液的pH约为2。
(1)写出HNO2的电离方程式___。
(2)将溶液加水稀释至10倍后,c(NO2-)___(填“增大”、“减小”或“不变”),n(H+)___(填“增大”、“减小”或“不变”),pH区间范围是___。
A.1~2 B.2~3 C.3~4 D.4~5
(3)分别取同浓度同体积的盐酸与亚硝酸,以同样的操作与足量NaOH溶液反应,测得反应溶液的最高温度盐酸要高于亚硝酸,说明可能的原因___。
(4)0.1mol·L-1 NaNO2溶液pH___7(填“>”、“<”或“=”),溶液中含有___种分子,溶液中c(Na+)___c(NO2-)(填“>”、“<”或“=”),下列措施能提高溶液中c(OH-)的是___。
A.适当升高温度 B.增加压强 C.加水 D.加入NH4Cl固体 E.加入Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液有关叙述正确的是
A.恒温条件下稀释氢氟酸时,HF的Ka增大,水的KW不变
B.向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大
C.0.1mol/LNaHCO3溶液中,c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com