
| A、①③ | B、②④ | C、①④ | D、只有② |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升髙温度,v正变大,v逆变小 |
| B、恒温恒容,充入O2,02的转化率升高 |
| C、恒温恒压,充人N2,平衡不移动 |
| D、恒温恒容,平衡前后混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、431 | B、649 |
| C、896 | D、945.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1=c2 |
| B、c1>c2 |
| C、c1≥c2 |
| D、c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A、曲线Ⅱ对应的条件改变是降低压强 |
| B、若曲线I对应的条件改变是升高温度,则该反应△H>0 |
| C、反应开始至a点时v(H2)=1mol?L-1?min-1 |
| D、其它条件不变,若降低该反应的温度,平衡常数值将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
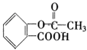 )具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等多方面的药理作用,是应用最早、最广和最普通的解热镇痛药.写出阿司匹林与足量NaOH溶液共热反应的化学方程式:
)具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等多方面的药理作用,是应用最早、最广和最普通的解热镇痛药.写出阿司匹林与足量NaOH溶液共热反应的化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com